Clasificación de los elementos.
Por clase
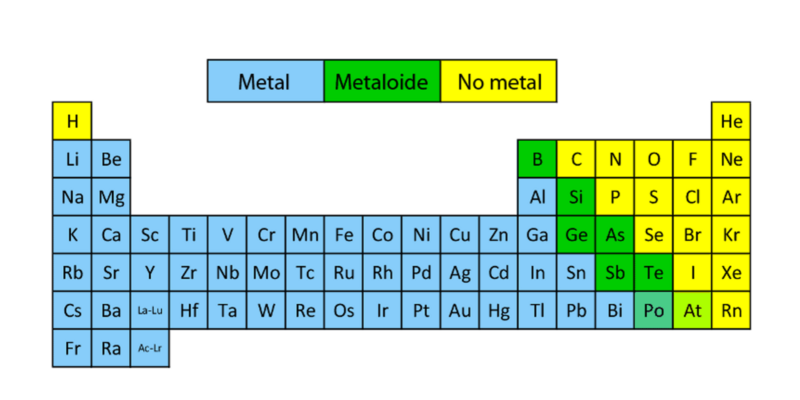
Metales
De los que más hay son los Metales y se subdividen en 6 grupos:
• Alcalinos (columna 1)
• Alcalinotérreos (columna 2)
• Metales de transición/ Bloque D (columnas 3 a la 12)
• Lantánidos (fila 6)
• Actínidos (fila 7)
• Otros Metales (columnas 13 a la 16)
No metales
Después están los Metaloides, estos son solamente 7 elementos de la tabla y se distribuyen entre las columnas 13 y 16.
Metaloides
Los No Metales se subdividen en 3 grupos:
• Otros No Metales (columnas 14 a la 16)
• Halógenos (columna 17)
• Gases Nobles (columna 18)
Por tipo
Representativo
Son aquellos que tienen su órbita externa incompleta. El electrón diferencial se encuentra en los subniveles s o p. comprende a los elementos que ocupan los grupos 1, 2, 13, 14, 15, 16 y 17 de la Tabla Periódica.
Gases nobles
Presentan su órbita electrónica externa completa con ocho electrones, con excepción del He, que tiene dos electrones. En ellos, la estructura electrónica externa es s2 p6, salvo en el He, que es s2 por tener un solo nivel de energía. Ocupan el grupo 18 de la Tabla Periódica.

Transición
Se caracterizan por presentar sus dos últimas órbitas incompletas. El electrón diferencial se ubica en los subniveles d. Esto significa que el electrón que se agrega lo hace en su anteúltima órbita. Corresponden a esta clase los elementos de los grupos 3, 4, 5, 6, 7, 8, 9, 10, 11 y 12 de la Tabla Periódica.
Transición Interna
Son los que presentan sus tres últimas órbitas incompletas. El electrón diferencial se halla en el subnivel f, es decir, que se incorpora a la antepenúltima órbita. Constituyen las denominadas tierras raras (lantánidos y actínidos) ubicadas generalmente al pie de la Tabla.
Por configuración electronica
Bloque s
en estos elementos el nivel energético más externo corresponde a orbitales s
Bloque p
en estos elementos el nivel energético más externo corresponde a orbitales p
Bloque d
en estos elementos el nivel energético más externo corresponde a orbitales d
Bloque f
tienen dos electrones s en sus niveles energéticos más externos (n) y electrones f en niveles más interiores (n-2). Algunos también tienen electrones d en niveles intermedios (n-1).
Por enlaces quimícos
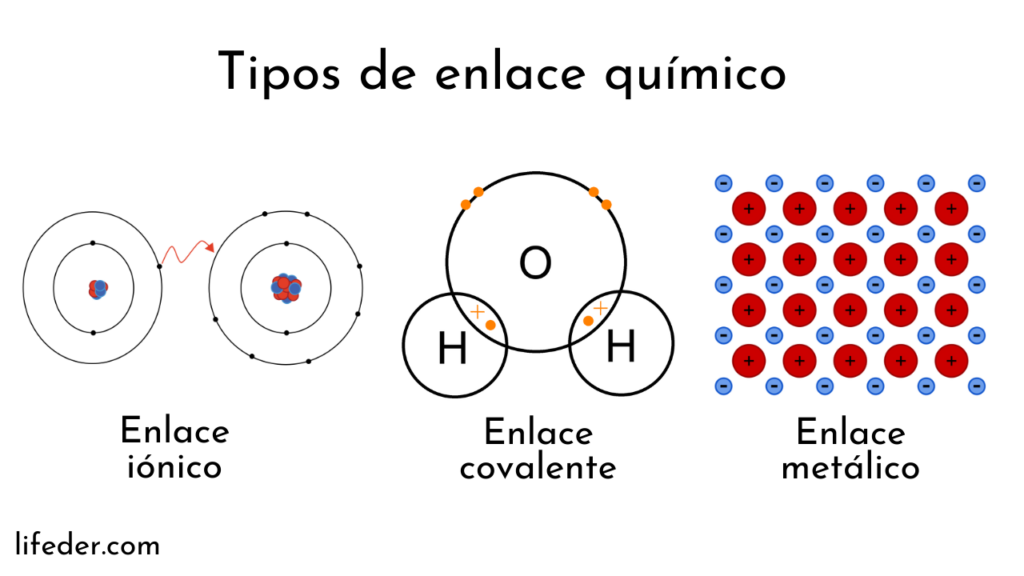
Covalente
Se produce cuando átomos no metálicos comparten electrones. Este tipo de enlace puede ser polar, cuando los electrones se comparten de manera desigual, o no polar, cuando se distribuyen equitativamente. Por ejemplo, en el agua (H2O), cada átomo de hidrógeno comparte electrones con un átomo de oxígeno.
Iónico
Se forma entre átomos metálicos y no metálicos, donde se produce una transferencia de electrones entre ellos. Esto resulta en la formación de iones con cargas opuestas (aniones negativos y cationes positivos), que se atraen entre sí. Por ejemplo, en el cloruro de sodio (NaCi), el sodio cede un electrón al cloro para cumplir con la ley del octeto.
Metalico
Se establece entre átomos de metales, donde los núcleos atómicos se rodean de una nube de electrones compartidos. Este enlace forma una estructura de red sólida. Ejemplos de elementos con enlaces metálicos son el oro (Au), el hierro (Fe) y el aluminio (Al).