Representando el átomo
Fue representado por
Demócrito
(antigua Grecia)
Planteó
Que la
materia estaba
compuesta de
átomos, y que
estos no tienen
división.
Demócrito inventó la palabra átomo, A (in) tomo (división).
Le faltaba información e investigación con el modelo científico
Aristóteles
(antigua Grecia)
Creía
Que la materia se podía
dividir infinitamente, y que estaba
compuesta por 5 elementos principales
(fuego, agua, tierra, aire y aether)
Dalton
(1808)
Experimentó

Con una lámina de oro, probando la teoría de demócrito
sobre la existencia del átomo.Su modelo
atómico consistía en una esfera sólida.
Sus postulados
Son
Una reacción química
implica solo la separación
combinación o reordenamiento
de los átomos. nunca supone
la creación o destrucción de los
mismos
Toda partícula está
formada por más de un
átomo. La relación es
un número entero o una
fracción sencilla
Todos los átomos de
un mismo elemento
son idénticos. Los átomos
de distintos elementos son
diferentes
Thompson
(1906)
Experimentó
Experimento de rayos catódicos
Consistía en una
botella al vacío que contenía de un lado una gran carga positiva y del otro una negativa, provocando que los electrones de los átomos del lado negativo viajen al positivo generando un rayo, Thompson puso placas con cargas opuestas al medio de la botella provocando que el rayo se desviara al lado de la carga positiva, probando que los electrones existían y que contenían una carga negativa.
Su modelo atómico
Consistía en

Una masa con carga positiva similar a la representada por Dalton pero tenía su carga negativa incrustada, este modelo se parece a un muffin de arándanos.
Sus
Principales descubrimientos
Descubrió el
electrón
Midió la relación
carga/masa
Presentó
Postulados
Toda la materia está constituida en su totalidad por átomos
Los átomos no se pueden crear o destruir
Rutherford
(1911)
Descubrió que

Los electrones están
moviéndose
constantemente
alrededor del núcleo
Experimentó
Experimento de la lamina de oro irradiada
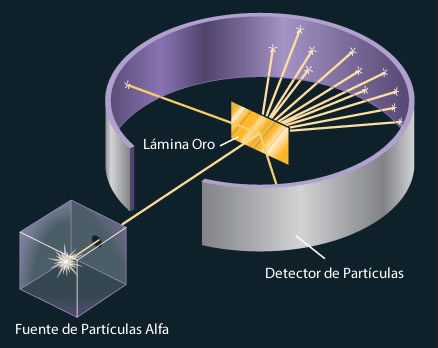
Descubrió el Núcleo y el vacío en el átomo que compone el 99% de este, por medio de un experimento que consistía en irradiar con rayos alpha (positivos) una lámina de oro. Se dio cuenta que el 99% pasaba y 1% se devolvía. Rutherford desvalido la teoría de su maestro, Thompson.
Bohr
(1913)
Descubrió que

Los electrones se encuentran en órbitas que van por niveles. Estos niveles solo podían contener una cierta cantidad de electrones y mientras la órbita estuviera más alejada del núcleo más electrones podía contener, solo podían haber un máximo de 7 órbitas y para que un electrón pudiera pasar de órbita el átomo tenía que recibir un mínimo de energía que le podía permitir al electrón hacer algo llamado un "salto cuántico"
Salto cuántico
Consiste en
Un movimiento discontinuo de un electrón entre órbitas, es comparable a la "teletransportacion".
Átomo
Posee
Núcleo

Compone el 1% del átomo, es esencial para la integridad de este y se encuentra en el centro. Aquí se encuentran los protones y neutrones
Orbitales
Los electrones
se encuentra aquí, tienen una cantidad limitada de electrones que puede contener y contiene una mayor cantidad de electrones mientras más alejada esté la orbital del núcleo.
Electrones
Partícula subatómica con una carga
negativa, se encuentra en un movimiento constante y genera energía eléctrica cuando se desplaza entre átomos
Neutrones

Partícula subatómica con una carga
neutra, funciona como "pegamento",
une a los protones del núcleo evitando
de que repelan naturalmente
Protones

Partícula subatómica con una carga
positiva, se encuentra en el núcleo
Es
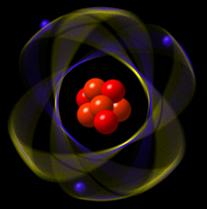
La unidad básica de la materia
que compone todo elemento,
su contenido son los electrones,
protones y neutrones.
La composición de cada átomo define el elemento que forma y como se comporta