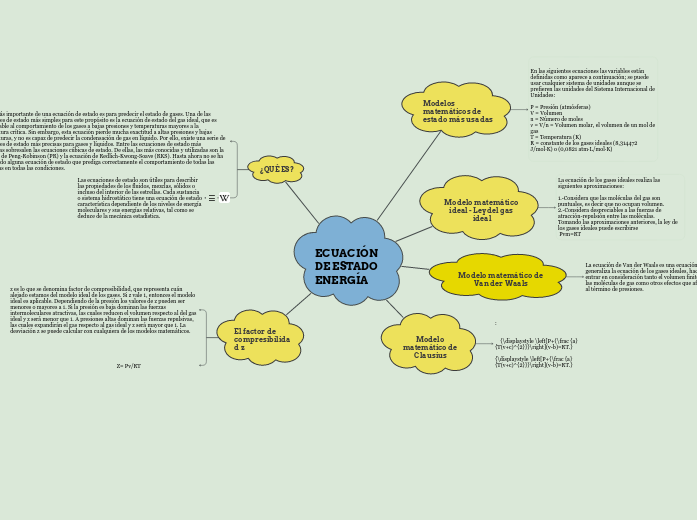
ECUACIÓN DE ESTADO ENERGÍA
This template is designed to help you with studying for an exam or qualification. The ideas behind it are described in this article together with tips and suggestions for study techniques.
Begin by typing in the name of the subject that you are studying.
El factor de compresibilidad z
The rest of the map (outside the Dashboard and baseline) is for Mind Mapping or Concept Mapping your notes and summaries. If you use multiple maps, make links to them from this one.
Z= Pv/RT
z es lo que se denomina factor de compresibilidad, que representa cuán alejado estamos del modelo ideal de los gases. Si z vale 1, entonces el modelo ideal es aplicable. Dependiendo de la presión los valores de z pueden ser menores o mayores a 1. Si la presión es baja dominan las fuerzas intermoleculares atractivas, las cuales reducen el volumen respecto al del gas ideal y z será menor que 1. A presiones altas dominan las fuerzas repulsivas, las cuales expandirán el gas respecto al gas ideal y z será mayor que 1. La desviación z se puede calcular con cualquiera de los modelos matemáticos.
¿QUÉ ES?
Map out what you already know about this subject. This will help you to connect new learning with previous knowledge.
Las ecuaciones de estado son útiles para describir las propiedades de los fluidos, mezclas, sólidos o incluso del interior de las estrellas. Cada sustancia o sistema hidrostático tiene una ecuación de estado característica dependiente de los niveles de energía moleculares y sus energías relativas, tal como se deduce de la mecánica estadística.
Las ecuaciones de estado son útiles para describir las propiedades de los fluidos, mezclas, sólidos o incluso del interior de las estrellas. Cada sustancia o sistema hidrostático tiene una ecuación de estado característica dependiente de los niveles de energía moleculares y sus energías relativas, tal como se deduce de la mecánica estadística.
El uso más importante de una ecuación de estado es para predecir el estado de gases. Una de las ecuaciones de estado más simples para este propósito es la ecuación de estado del gas ideal, que es aproximable al comportamiento de los gases a bajas presiones y temperaturas mayores a la temperatura crítica. Sin embargo, esta ecuación pierde mucha exactitud a altas presiones y bajas temperaturas, y no es capaz de predecir la condensación de gas en líquido. Por ello, existe una serie de ecuaciones de estado más precisas para gases y líquidos. Entre las ecuaciones de estado más empleadas sobresalen las ecuaciones cúbicas de estado. De ellas, las más conocidas y utilizadas son la ecuación de Peng-Robinson (PR) y la ecuación de Redlich-Kwong-Soave (RKS). Hasta ahora no se ha encontrado alguna ecuación de estado que prediga correctamente el comportamiento de todas las sustancias en todas las condiciones.
Modelo matemático de Clausius
:
{\displaystyle \left[P+{\frac {a}{T(v+c)^{2}}}\right](v-b)=RT.}
{\displaystyle \left[P+{\frac {a}{T(v+c)^{2}}}\right](v-b)=RT.}
Modelo matemático de Van der Waals
La ecuación de Van der Waals es una ecuación que generaliza la ecuación de los gases ideales, haciendo entrar en consideración tanto el volumen finito de las moléculas de gas como otros efectos que afectan al término de presiones.
{\displaystyle \left(P+{\frac {a}{\upsilon ^{2}}}\right)\left(\upsilon -b\right)=RT}
Modelo matemático ideal - Ley del gas ideal
Add resources that will help your studies in the topics below.
La ecuación de los gases ideales realiza las siguientes aproximaciones:
1.-Considera que las moléculas del gas son puntuales, es decir que no ocupan volumen.
2.-Considera despreciables a las fuerzas de atracción-repulsión entre las moléculas.
Tomando las aproximaciones anteriores, la ley de los gases ideales puede escribirse
Pvm=RT
What communities exist around this subject that you could join and learn from? Think about online groups, professional associations, special interest groups, or societies.
Modelos matemáticos de estado más usadas
The 'dashboard' topic holds useful information to help organise your studies. It is separate from the notes themselves.
En las siguientes ecuaciones las variables están definidas como aparece a continuación; se puede usar cualquier sistema de unidades aunque se prefieren las unidades del Sistema Internacional de Unidades:
P = Presión (atmósferas)
V = Volumen
n = Número de moles
ν = V/n = Volumen molar, el volumen de un mol de gas
T = Temperatura (K)
R = constante de los gases ideales (8,314472 J/mol·K) o (0,0821 atm·L/mol·K)
Map out the syllabus for this subject in the tree below. If you have not received a syllabus, make sure you get a copy.