Átomo
Que es?
El átomo es la unidad constituyente más pequeña de la materia que tiene las propiedades de un elemento químico. Cada sólido, líquido, gas y plasma se compone de átomos neutros o ionizados.
Modelos atómicos
El modelo atómico es una representación estructural de un átomo que trata de explicar su comportamiento y propiedades. Son 8:

Modelo de Bohr:
La estabilidad de la materia se debe a que los electrones solo pueden girar alrededor del núcleo
positivo en determinadas órbitas circulares, denominadas niveles o estados de energía.

Ensayo a las llamas
Los electrones tienen mayor energía cuanto más alejados se encuentran del núcleo. Debido a este hecho, cuando un electrón pasa de una órbita externa a otra más cercana al núcleo, emite energía en forma de luz. Esta energía emitida es lo que llamamos espectro de emisión del átomo.
Para determinar la presencia de algunos elementos metálicos se puede utilizar el llamado ENSAYO A LA LLAMA, ya que los compuestos de algunos metales son volátiles en la llama de un mechero de Bunsen y le imparten un color característico.
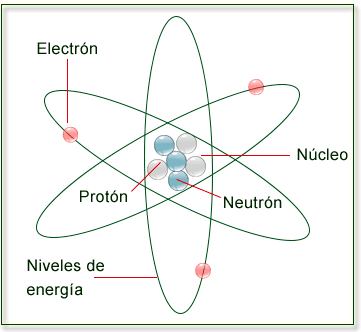
Estructura del átomo
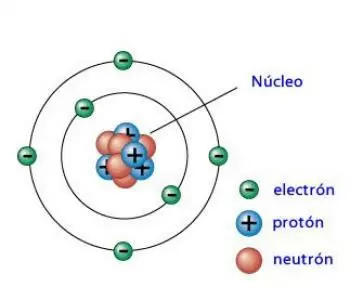
Número atómico es
igual al número total de
protones en el núcleo del átomo.
La suma del número de
protones + neutrones es igual al
numero de electrones.
ISOTOPOS
Llamamos isótopos a las formas
atómicas de un mismo elemento que se
diferencian en su número másico.
ESPECIES CON CARGA ELECTRICA
Si un átomo neutro gana o pierde electrones,
se convierte en un ION.
ANIÓN: Si gana electrones, sera negativo.
CATION: Si pierde electrones, sera positivo.
Configuración electrónica
La configuración electrónica indica la manera en la cual los electrones se estructuran, comunican u organizan en un átomo de acuerdo con el modelo de capas electrónicas.
Para determinar la configuración electrónica de un elemento, basta con calcular cuántos electrones hay que acomodar y entonces distribuirlos en los subniveles empezando por los de menor energía e ir llenando hasta que todos los electrones estén distribuidos.
Cada nivel esta dividido en subniveles: Existen 4: S, P,D y F
Cada subnivel está dividido en una cantidad definida de orbitales.
El s tiene 1 orbital y 2e- como max.
El p contiene 3 orbitales y 6e-
El d contiene 5 orbitales y 10 e-
El f contiene 7 orbitales y 14 e-.
Una regla practica para realizar el orden y llenado de los orbitales es: LA REGLA DEL SERRUCHO.
