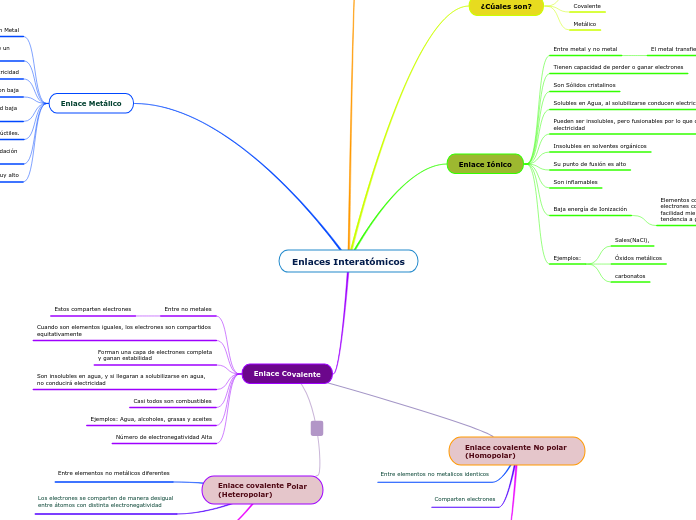
Enlaces Interatómicos
¿Qué son?
fuerza que se forma entre los átomos para producir las moléculas,
para dar lugar a estructuras más estables que los átomos o moléculas de partida.
¿Cúales son?
Iónico
Covalente
Metálico
Enlace Iónico
Entre metal y no metal
El metal transfiere sus electrones al no metal
Tienen capacidad de perder o ganar electrones
Son Sólidos cristalinos
Solubles en Agua, al solubilizarse conducen electricidad
Pueden ser insolubles, pero fusionables por lo que conducen electricidad
Insolubles en solventes orgánicos
Su punto de fusión es alto
Son inflamables
Baja energía de Ionización
Elementos con baja energías de ionización tienen la tendencia a perder electrones con
facilidad mientras que elementos con alta afinidad electrónica tienen la tendencia a ganarlos.
Ejemplos:
Sales(NaCl),
Óxidos metálicos
carbonatos
Enlace Metálico
Entre Metal con Metal
Los electrones de valencia se mueven continuamente de un átomo a otro
Son buenos conductores de electricidad
Energía de Ionizacion baja
Electronegatividad baja
(Son cationes)
son brillantes, con estructura cristalina, maleables y dúctiles.
Loes metales tienden a tener un proceso llamado Oxidación
(Pierden eletrones)
Tienen punto de fusión muy alto
Enlace Covalente
Entre no metales
Estos comparten electrones
Cuando son elementos iguales, los electrones son compartidos equitativamente
Forman una capa de electrones completa
y ganan estabilidad
Son insolubles en agua, y si llegaran a solubilizarse en agua, no conducirá electricidad
Casi todos son combustibles
Ejemplos: Agua, alcoholes, grasas y aceites
Número de electronegatividad Alta