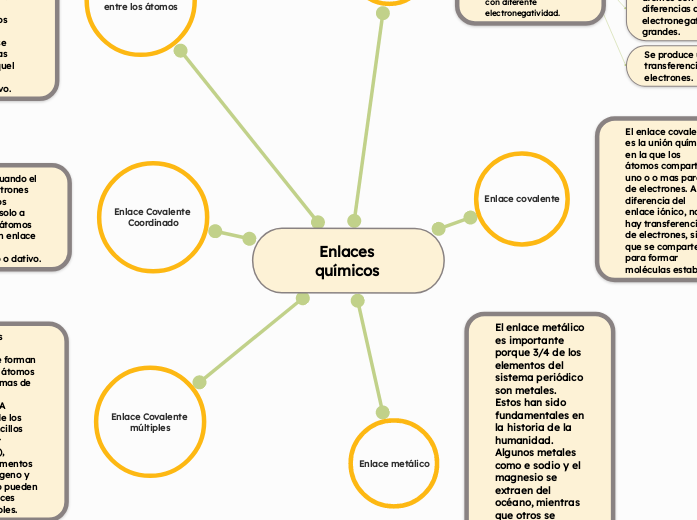
Enlaces químicos
Enlace Ionico
Es el tipo de union quimica entre atomos, donde uno de ellos transfiere un electron al otro. Se establece normalmente entre metales y no metales con diferente electronegatividad.
Estan formados por metal + no metal.
No forma moleculas verdaderas, existe como un agregado de aniones(iones negativos) y cationes(iones positivos).
Se establece entre atomos con diferencias de electronegatividad grandes.
Se produce una transferencia de electrones.
Enlace covalente
El enlace covalente es la unión química en la que los átomos comparten uno o o mas pares de electrones. A diferencia del enlace iónico, no hay transferencia de electrones, sino que se comparten para formar moléculas estables.
Enlace metálico
El enlace metálico es importante porque 3/4 de los elementos del sistema periódico son metales. Estos han sido fundamentales en la historia de la humanidad. Algunos metales como e sodio y el magnesio se extraen del océano, mientras que otros se obtienen de depósitos minerales o se encuentran en forma elemental (como el oro y la plata).
Enlaces covalentes entre los átomos
El enlace covalente polar se forma entre dos átomos no metálicos que tienen una diferencia de electronegatividad entre 0, 4 y 1, 7. Cuando estos interactúan, los electrones compartidos se mantienen mas próximos a aquel átomo mas electronegativo.
Enlace Covalente Coordinado
Se forma cuando el par de electrones compartidos pertenece solo a uno de los átomos presenta un enlace covalente coordinado o dativo.
Los átomos deben acomodarse de tal manera que la molécula resulte lo mas simétrica posible.
El carbono tiene preferencia como átomo central sobre el resto de elementos.
El oxigeno y el hidrogeno no pueden ser átomos centrales.
Enlace Covalente múltiples
Los en laces covalentes múltiples se forman cuando dos átomos comparten mas de un par de electrones. A diferencia de los enlaces sencillos (un solo par compartido), algunos elementos como el oxigeno y el nitrógeno pueden formar enlaces dobles o triples.