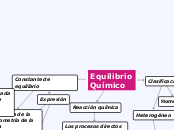
Equilibrio Químico
Reacción química
Los procesos directos e inversos se producen a una misma velocidad
Formación de una mezcla de equilibrio de reactivos y productos
Constante de equilibrio
Depende solo de la estequiometrìa de la reacción
Para una determinada temperatura tengo una constante de equilibrio
Expresión
Kp=(PC)c(PD)d
(PA)a(PB)b
de un equilibrio
en fase gaseosa
Kc= [C]c [D]d
[ A]a [B]b
de un equilibrio en fase acuoso
Clasificación
Homogéneo
Todas las sustancias están en la misma fase
Heterogéneo
Están presentes dos
o mas fases