LA TEORIA CINÈTICA DELS GASOS
La teoria cinètica suposa que els gasos:
Estan formats per partícules molts petites
que estan separades les unes de les altres.
El volum de les partícules és molt més petit
que el volum del recipient.
No hi ha forces d'unió entre les partícules
d'un gas. Per això es mouen amb total
llibertat.
Les partícules del gas es mouen en
línia recta. Només canvien de direcció
quan xoquen amb una altra particular
o amb les parets.
La pressió que exerceix el gas és
una mesura del nombre de xocs
per segon de les seves partícules
contra les parets del recipient.
La temperatura absoluta dels gas és
proporcional a la velocitat de les
partícules que el formen, com més
velocitat, més alta serà la temperatura.
Els gasos i la pressió
atmosfèrica
El volum es mesura en unitats
de capacitat, com el litre o el
mil·lilitre. En el SI es mesura
en m3, però sovint utilitzem
submúltiples com el dm3 o cm3.
1m3=1000L
1dm3=1L
1cm3=1mL
La temperatura es mesura amb un
termòmetre. Habitualment s'utilitza
l'escala Celsius (ºC), però l'unitat
del SI es el Kelvin (K).
T(K)=T(ºC)+273
La pressió es mesura amb un
manòmetre. La unitat del SI es
el Pascal (Pa), però en els estudis
es fa servir l'atmosfera (atm) o
el mil·límetre de mercuri (mmHg).
1atm=760mmHg=101325Pa
Anomenem pressió atmosfèrica
la pressió que exerceix l'aire.

Llei de Boyle-Mariotte
Temperatura constant


Llei de Gay-Lussac
Volum constant


Llei de Charles
Pressió constant

Llei dels gasos ideals
Aquesta equació s'anomena
equació general dels gasos
ideals.

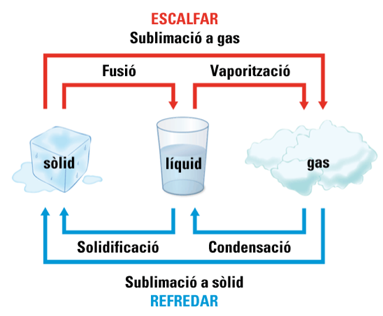
Cambis d'estat