Equilibrio Químico
Condición de equilibrio
Las condiciones de equilibrio son las leyes que rigen la estática.
La estática es la ciencia que estudia las fuerzas que se aplican a un cuerpo para describir un sistema en equilibrio.
-Primera condición de equilibrio:
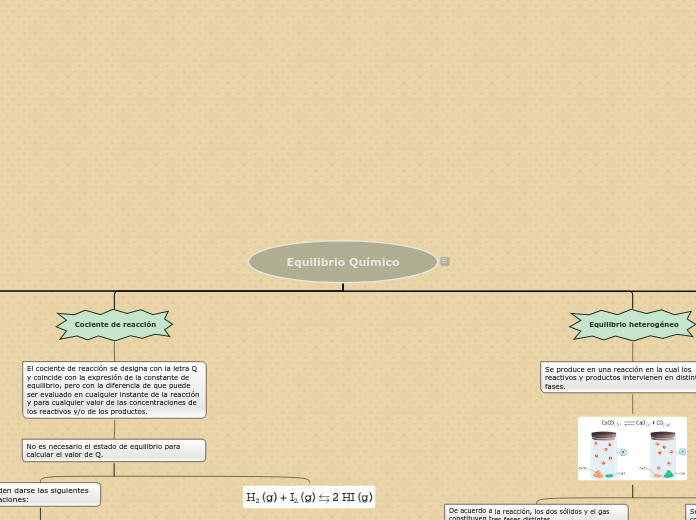
Diremos que un cuerpo se encuentra en equilibrio de traslación cuando la fuerza resultante de todas las fuerzas que actúan sobre él es nula: ∑ F = 0.
Segunda condición de equilibrio:
Un cuerpo está en equilibrio de rotación cuando la suma de todas las fuerzas que se ejercen en él respecto a cualquier punto es nula.
Se tiene que cumplir que la suma de los momentos o fuerzas asociados a las rotaciones antihorarias (en el sentido contrario de las agujas del reloj), tiene que ser igual a la suma aritmética de los momentos o fuerzas que están asociados a las rotaciones horarias (en el sentido de las agujas del reloj)
Un cuerpo se encuentra en equilibrio traslacional y rotacional cuando se verifiquen de forma simultánea las dos condiciones de equilibrio.
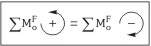
Constante de equilibrio
La constante de equilibrio (K) se expresa como la relación entre las concentraciones molares (mol/l) de reactivos y productos. Su valor en una reacción química depende de la temperatura
Kc es una constante para una reacción específica a una temperatura específica.
Cuando se trata de mezclas gaseosas, a veces resulta más adecuado describir la composición en términos de presiones parciales.
La magnitud de la constante de equilibrio informa sobre el estado de equilibrio, es decir, sobre la extensión con que una reacción química se lleva a cabo.
Kp y Kc se relacionan mediante la ley de los gases ideales, de forma que conocida una puede conocerse la otra:
PV = nRT Þ P = (n/V) RT Þ P = cRT
Kp = Kc (RT)Dn
Dn = ngas (productos) - ngas (reactivos)
Cociente de reacción
El cociente de reacción se designa con la letra Q y coincide con la expresión de la constante de equilibrio, pero con la diferencia de que puede ser evaluado en cualquier instante de la reacción y para cualquier valor de las concentraciones de los reactivos y/o de los productos.
No es necesario el estado de equilibrio para calcular el valor de Q.
Pueden darse las siguientes situaciones:
Si Q = Kc, el sistema esta en equilibrio.
Si Q < Kc, significa que el cociente de las concentraciones iniciales es menor que el que debería ser en el equilibrio.
Si Q ¹? Kc, el sistema evolucionará hacia el estado de equilibrio.
Si Q > Kc, el valor del cociente de las concentraciones iniciales es superior al que corresponde al estado de equilibrio.
Equilibrio heterogéneo
Se produce en una reacción en la cual los reactivos y productos intervienen en distintas fases.

De acuerdo a la reacción, los dos sólidos y el gas constituyen tres fases distintas

En estos equilibrios tendremos que tener en cuenta que en su constante no debemos introducir sólidos (ya que no tiene sentido hablar de concentración de un sólido no disperso en el medio).
Se relacionan con la disolución o precipitación de compuestos iónicos
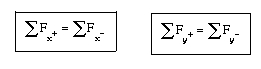
Relación entre energía libre de Gibbs y ctte de equilibrio
Energia libre de Gibbs
Es un potencial termodinámico que
da la condición de equilibrio y espontaneidad
[ ΔG°=ΔH°
−TΔS°s
KEQ
Las concentraciones de
reactivos y productos permanecen constantes en presión y temperatura
RELACION
Cuando se quiere sacar
G en una reacción que no es estándar se utiliza la energía gibbs molar de reacción
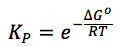
Ecuación de van Hoff
Una descripción cuantitativa de la variación de una constante de equilibrio en la temperatura
La ecuación de Van’t Hoff es comúnmente utilizada para determinar los valores de constantes de equilibrio a una cierta temperatura a partir de los valores de otra temperatura.

Van’t Hoff verificó una relación de semejanza entre la presión de los gases y la presión osmótica de las soluciones diluídas.
Otra forma de la ecuación de Van’t Hoff describe el cambio de la constante de equilibrio hacia la concentración Kc con la temperatura:
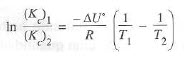
Es la versión general más actualizada de la ecuación de Clapeyron que describe la variación de la temperatura en función de la presión de vapor.