TERMOQUIMICA
PRINCIPIO DE LE CHATELIER
Si se presenta una perturbación externa sobre un sistema en equilibrio, el sistema se ajustará de tal manera que se cancele parcialmente dicha perturbación en la medida que el sistema alcanza una nueva posición de equilibrio.

EQUILIBRIO QUIMICO
Es el estado en el que las actividades químicas o las concentraciones de los reactivos y los productos no tienen ningún cambio neto en el tiempo.

LEY DE HESS
"En una reacción química expresada como la suma (o diferencia) algebraica de otras reacciones químicas, puesto que es función de estado, la entalpía de reacción global es también la suma (ó diferencia) algebraica de las entalpías de las otras reacciones."

TERMODINÁMICA
Es la rama de la física que describe los estados de equilibrio termodinámico a nivel macroscópico

SISTEMAS
ABIERTO
Es un sistema físico que interactúa con otros agentes químicos, por lo tanto está conectado correccionalmente con factores externos a él.

CERRADO
Es un sistema físico que no interactúa con otros agentes físicos situados fuera de él y por tanto no está conectado causalmente ni relacionado con nada externo a él.

TIPOS DE REACCIONES
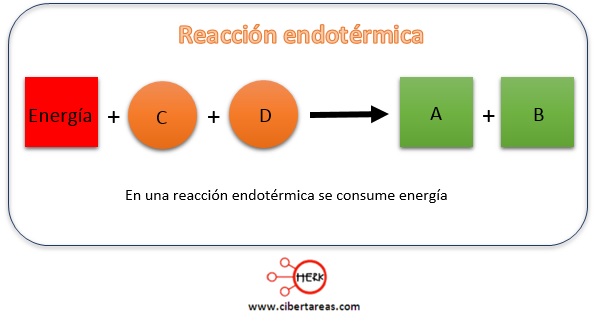
ENDOTERMICAS
Es aquella que tiene un incremento de entalpía (ΔH) positivo. Es decir, la energía que poseen los productos es mayor a la de los reactivos.
EXOTERICAS
Se denomina reacción exotérmica a cualquier reacción química que desprenda energía, ya sea como luz o calor,1 o lo que es lo mismo: con una variación negativa de la entalpía; es decir: -ΔH.

LEY DE ACCIÓN DE MASAS
Establece que para una reacción química reversible en equilibrio a una temperatura constante, una relación determinada de concentraciones de reactivos y productos tiene un valor constante.

PRIMER PRINCIPIO DE LA TERMODINÁMICA
Un sistema termodinámico puede intercambiar energía con su entorno en forma de trabajo y de calor, y acumula energía en forma de energía interna.

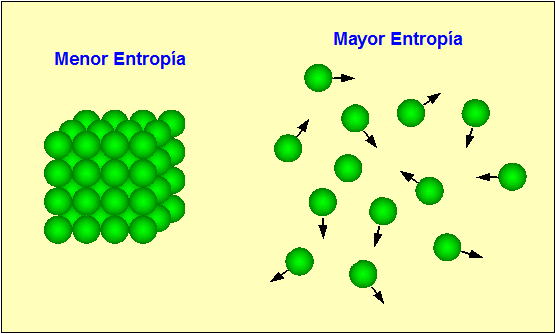
ENTROPIA
Es una magnitud física que para un sistema termodinámico en equilibrio mide el número de microestados compatibles con el macroestado de equilibrio, o que es la razón de un incremento entre energía interna frente a un incremento de temperatura del sistema.
CALOR
La energía en tránsito que se reconoce solo cuando se cruza la frontera de un sistema termodinámico.

TERMOQUIMICA
Consiste en el estudio de las transformaciones que sufre la energía calorífica en las reacciones químicas, surgiendo como una aplicación de la termodinámica a la química.

COMPONENTES DE UNA REACCION QUIMICA

ENTALPIA
Es una magnitud termodinámica, simbolizada con la letra H mayúscula, cuya variación expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico

TEORIA DE LAS COLISIONES
“La velocidad de una reacción es proporcional al número de colisiones producidas por unidad de tiempo entre las moléculas de los reactivos.”

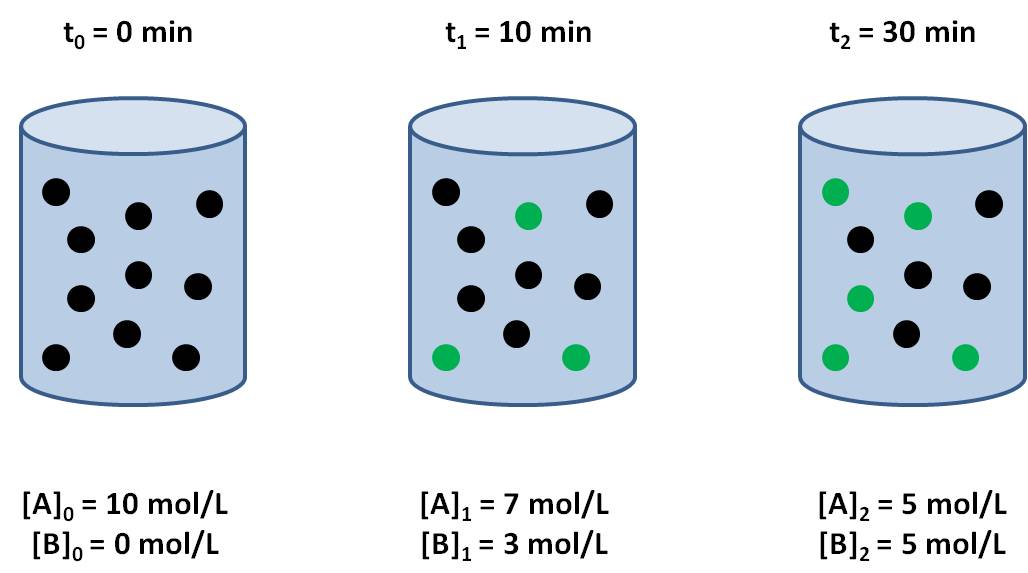
VELOCIDAD DE REACCIÓN
Se define como la cantidad de sustancia que reacciona por unidad de tiempo.