NUMERO DE AVOGADRO

La biografia de avogadro
Químico y físico italiano. Nació el 9 de junio de 1776 en Turín, Italia y murió el 9 de julio de 1856.
En 1792 se graduó como doctor en derecho canónico, pero no ejerció. En vez de ello, mostró verdadera pasión por la física y la química, y una gran destreza para las matemáticas.
Recapacitando sobre el descubrimiento de Charles (publicado por Gay -Lussac) de que todos los gases se dilatan en la misma proporción con la temperatura decidió que esto debía implicar que cualquier gas a una temperatura dada debía contener el mismo número de partículas por unidad de volumen. Avogadro tuvo la precaución de especificar que las partículas no tenían por qué ser átomos individuales sino que podían ser combinaciones de átomos (lo que hoy llamamos moléculas).
Con esta consideración pudo explicar con facilidad la ley de la combinación de volúmenes que había sido anunciada por Gay-Lussac y, basándose en ella, dedujo que el oxígeno era 16 veces más pesado que el hidrógeno y no ocho como defendía Dalton en aquella época.
Enunció la llamada hipótesis de Avogadro: iguales volúmenes de gases distintos contienen el mismo número de moléculas, si ambos se encuentran a igual temperatura y presión.
Ese número, equivalente a 6,022· 1023, es constante, según publicó en 1811. Como ha ocurrido muchas veces a lo largo de la historia las propuestas de Avogadro no fueron tomadas en cuenta, es más, Dalton, Berzelius y otros científicos de la época despreciaron la validez de su descubrimiento y la comunidad científica no aceptó de inmediato las conclusiones de Avogadro por tratarse de un descubrimiento basado en gran medida en métodos empíricos y válido solamente para los gases reales sometidos a altas temperaturas pero a baja presión.
Sin embargo, la ley de Avogadro permite explicar por qué los gases se combinan en proporciones simples.
EJERCICIOS DE AVOGADRO
EJERCICIO
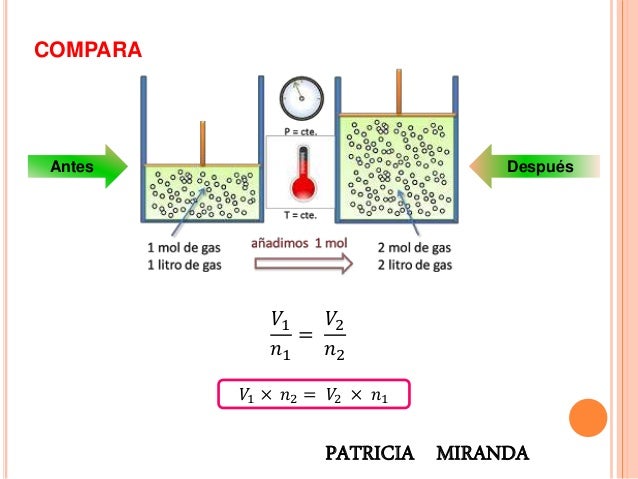
COMPARA
Leyes de avogadro
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.

LEYES
Que es el numero de avogadro

En química, se denomina número de Avogadro o Constante de Avogadro al número de partículas constituyentes de una sustancia (normalmente átomos o moléculas) que se pueden encontrar en la cantidad de un mol de dicha sustancia. Dicho en términos más simples, es un factor de proporción que pone en relación la masa (cantidad de materia) típica de una sustancia y la masa presente en una muestra de la misma.
El valor aceptado de esta constante es de 6,022 140 857 (74) x1023 mol-1.
En la actualidad se emplea el término Constante de Avogadro en lugar de “número”, ya que antiguamente solía preferirse este término pero se definía mediante cálculos diferentes. Jean Baptiste Perrin, de hecho, lo definió inicialmente como el número de átomos que hay en un mol de hidrógeno (H); pero luego se redefinió como el número de átomos en 12 gramos de carbono-12, antes de que fuera generalizado para poder aplicarse proporcionalmente a cualquier tipo de sustancias.
Por ende, el número de Avogadro es un valor adimensional. En 1 gramo de hidrógeno hay un aproximado de 6,022 x 1023 átomos de hidrógeno, mientras que en 12 gramos de carbono-12 hay exactamente la misma cantidad de átomos. Esto se debe a que los átomos tienen tamaños distintos dependiendo del elemento, claro está. Pero sirve para saber cuánto hay que emplear de cada sustancia para tener una idéntica cantidad de átomos.