QUÍMICA
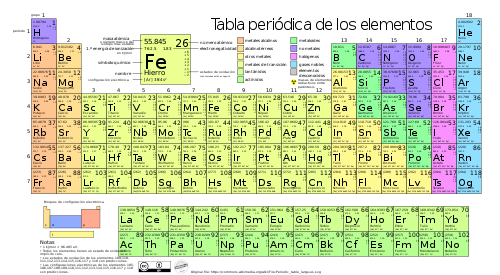
TABLA
PERIÓDICA
Disposición de los elementos
químicos en forma de tabla.
ELEMENTOS

METALES
Buenos conductores
del calor y la electricidad
Alta densidad
Sólidos a
temperatura ambiente
Sus sales forman cationes

NO METALES
No son buenos conductores de
la corriente eléctrica y el calor.
Muy débiles
Esenciales para
los sistemas biológicos.

GASES NOBLES
Gases monoatómicos
inodoros e incoloros
Bajo condiciones
normales
Reactividad química
muy baja

CONFIGURACIÓN
ELECTRÓNICA
Distribución de los electrones
de un átomo en...
Diferentes niveles y
subniveles de energía.
ELECTRONEGATIVIDAD
Capacidad o poder de un átomo
de atraer a electrones hacia sí.
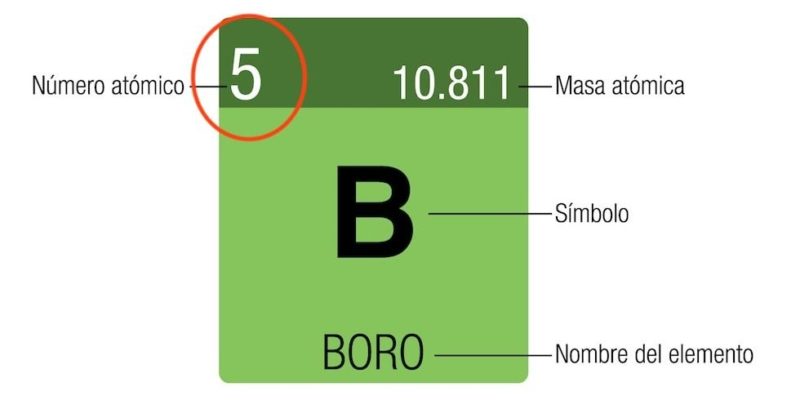
NÚMERO
MÁSICO
Se simboliza con la A.
Número total de
párticulas en el núcleo.
Protones + Neutrones
ATÓMICO
Se representa con la Z.
Número total de
protones de un átomo.
ESTADO
DE OXIDACIÓN
Cantidad de e- que pone
un átomo para formar enlaces.
Número de e- que
un átomo recibe (-) ...
Pone a disposición (+)
formando compuestos
UNIONES
QUÍMICAS
Fuerza de atracción que
mantiene unidos a átomos,
moléculas e iones,
de naturaleza eléctrica.

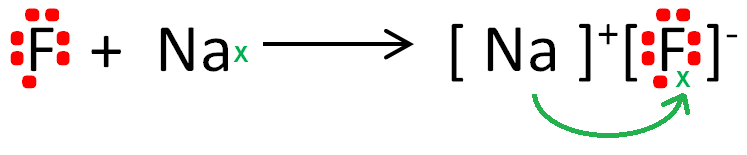
IÓNICA
Metal y no metal.
Transferencia de electrones:
El METAL pierde
sus electrones...
El NO METAL los gana.

COVALENTE
Solo entre No Metales.
Comparten uno o más e-
para completar el octeto.
POLAR
(0.5 a 1.7)
-Distribución desigual.
-Polo negativo y positivo.
NO POLAR
(- o = 0.4)
-Distribución uniforme.
-No hay polos.

METÁLICA
Solo entre Metales.
Estructuras muy
compactas
Electronegatividades
bajas
Electrones
"sin dueño"
Red cristalina
de cationes
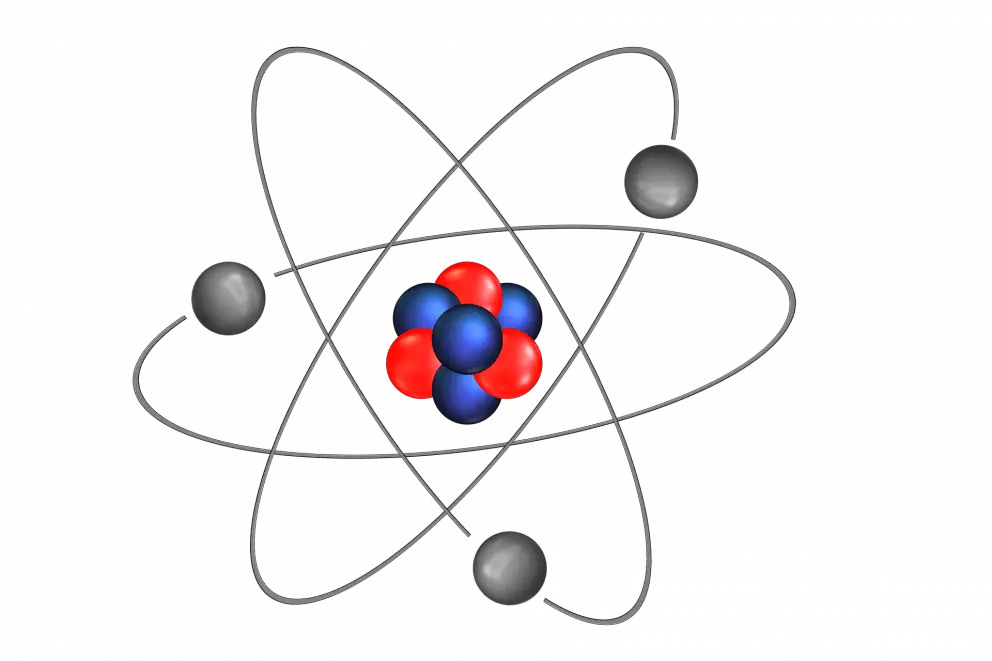
ÁTOMO

ESTRUCTURA
Orbitas
ELECTRONES
Partícula elemental
de carga negativa.
Núcleo
PROTONES
Partícula elemental
de carga positiva.
NEUTRONES
Partícula elemental
sin carga eléctrica.
ION
Átomo que presenta
carga positiva o negativa,
no hay neutralidad.
CATIÓN
Ion con carga positiva
ANIÓN
Ion con carga negativa
ISÓTOPO
Átomos del
mismo elemento
Mismo
número atómico
Cantidad de
electrones = protones
Diferente
número másico
Diferente cantidad
de neutrones
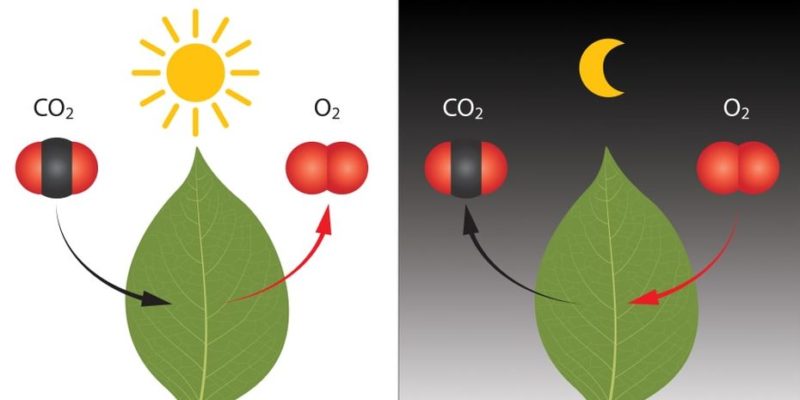
REACCIONES
QUÍMICAS
Proceso en que una o + sustancias (reactivos)
se transforman en otra/s sustancia/s
con propiedades diferentes (productos).
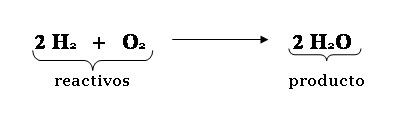
ECUACIONES
QUÍMICAS
Descripción simbólica
de una reacción química
A + B (Reactivos) --> C + D (Productos)
+ “reacciona por” y --> “produce”

INDICACIONES DE
REACCIÓN QUÍMICA
-Evolución del calor,
la luz, el sonido, etc.
-Producción
de un gas
-Cambio de color,
sabor, textura, etc.

EJEMPLOS
-Combustión
-Oxidación
-Fotosíntesis
-Putrefacción
-Respiración