LOS GASES
PROPIEDADES
son
Presión (P)
Volumen (P)
Moles (n)
Temperatura (T)
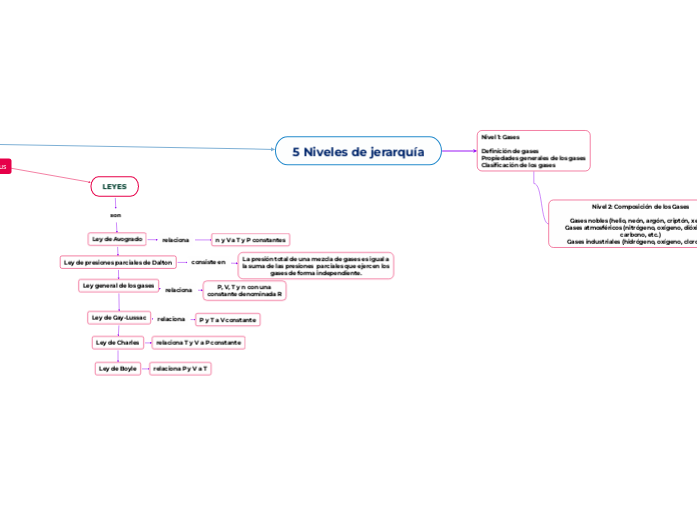
LEYES
son
Ley de Avogrado
Ley de presiones parciales de Dalton
Ley general de los gases
Ley de Gay-Lussac
Ley de Charles
Ley de Boyle
relaciona P y V a T
relaciona T y V a P constante
relaciona
P y T a V constante
relaciona
P, V, T y n con una
constante denominada R
consiste en
La presión total de una mezcla de gases es igual a
la suma de las presiones parciales que ejercen los
gases de forma independiente.
relaciona
n y V a T y P constantes
sus
son muy
comprensibles
se
mezclan facilmente
sus
DENSIDADES
son
MENORES
que las de
sólidos y líquidos
tienen
Forma
son
Indefinidos
Volumen
5 Niveles de jerarquía
Nivel 1: Gases
Definición de gases
Propiedades generales de los gases
Clasificación de los gases
Nivel 2: Composición de los Gases
Gases nobles (helio, neón, argón, criptón, xenón)
Gases atmosféricos (nitrógeno, oxígeno, dióxido de carbono, etc.)
Gases industriales (hidrógeno, oxígeno, cloro, etc.)
Nivel 3: Comportamiento de los Gases
Ley de Boyle-Mariotte (relación entre presión y volumen)
Ley de Charles (relación entre volumen y temperatura)
Ley de Gay-Lussac (relación entre presión y temperatura)
Ley de los gases ideales
Desviaciones del comportamiento ideal
Nivel 4: Propiedades y Características Específicas
Presión atmosférica
Volumen molar
Difusión y efusión de los gases
Diagrama de fase de los gases
Teoría cinética de los gases
Nivel 5: Aplicaciones y Significado
Aplicaciones industriales (soldadura, refrigeración, etc.)
Gases en la medicina (oxígeno medicinal, anestésicos, etc.)
Efectos en el medio ambiente (efecto invernadero, contaminación)
Gases en la investigación científica (gases traza, experimentos)
Seguridad en el manejo de gases (almacenamiento, transporte)