Calor
Leyes de la termodinámica
ley cero
primera ley
en base
principio de conservación de la energía
energia
no se crea
ni se destruye
solo se transforma
Calor cedido y absorbido
energía total de un sistema aislado
aislado
o cerrado
esta
conserva
calorimetro
cuando
transferencia de calor
entre dos
cuerpos
sistemas
presenta que
cantidad de calor cedido por un cuerpo/sistema A
Qc
cantidad de calor absorbido por un cuerpo/sistema B
Qa
son iguales
Qc = Qa
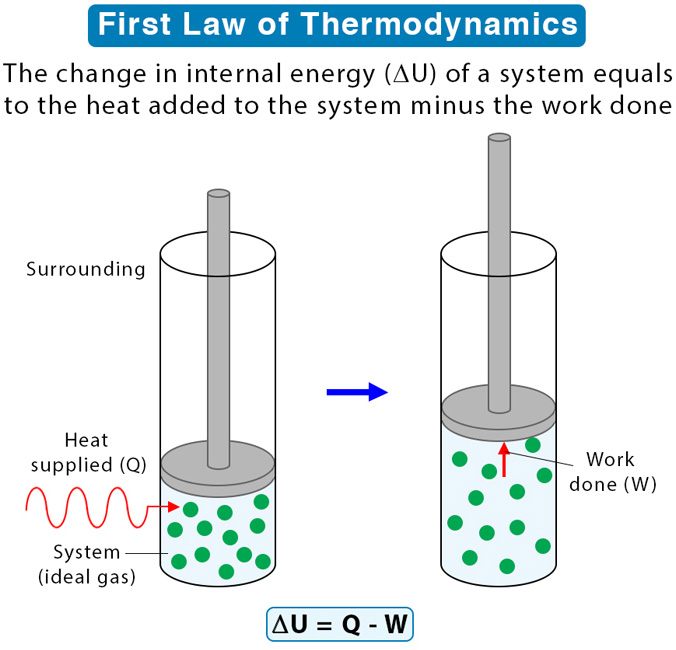
Energía interna
cuerpo
U
cuando pasa
estado inicial
Ui
a
estado final
Uf
existe
intercambio energía
vecindad
ΔU = Uf - Ui
sistema
recibe calor
ΔQ > 0
aumentando energía interna
Uf = Ui + ΔQ
Uf > Ui
entonces
volumen se expande
Vf = Vi + ΔV
ΔV > 0
supongamos que se ejerce un trabajo por el sistema
W > 0
conllevando
disminuir la energia interna
expulsa calor
ΔQ < 0
disminuye energía interna
Uf = Ui + ΔQ
Uf < Ui
entonces
volumen se comprime
Vf = Vi + ΔV
ΔV < 0
supongamos que se ejerce un trabajo sobre el sistema
W < 0
conllevando
aumento la energía interna
Transformaciones termodinámicas

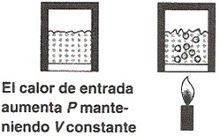
transformación isobárico
donde los valores del sistema
constante
Presión interna
Pi
variable
volumen
V
temperatura interna
Ti
energia interna
U
dependiendo del valor
calor
ΔQp
utiliza
masa del sistema
M
calor especifico a presión constante
cp
variación de temperatura
ΔT
expresada
ΔQp = M cp ΔT
cuando se presenta
expansión
calor absorbido
ΔQp > 0
conlleva
cambio
Volumen
ΔV > 0
Energía Interna
ΔU > 0
ejerza
trabajo por el sistema
W > 0
contracción
calor expulsado
ΔQp < 0
conlleva
cambio
Volumen
ΔV < 0
Energía Interna
ΔU < 0
ejerza
trabajo sobre el sistema
W < 0
Subtopic
diagrama P - V
Ley de Charles
Ta <> Tb
Pa = Pb => Va / Ta = Vb / Tb
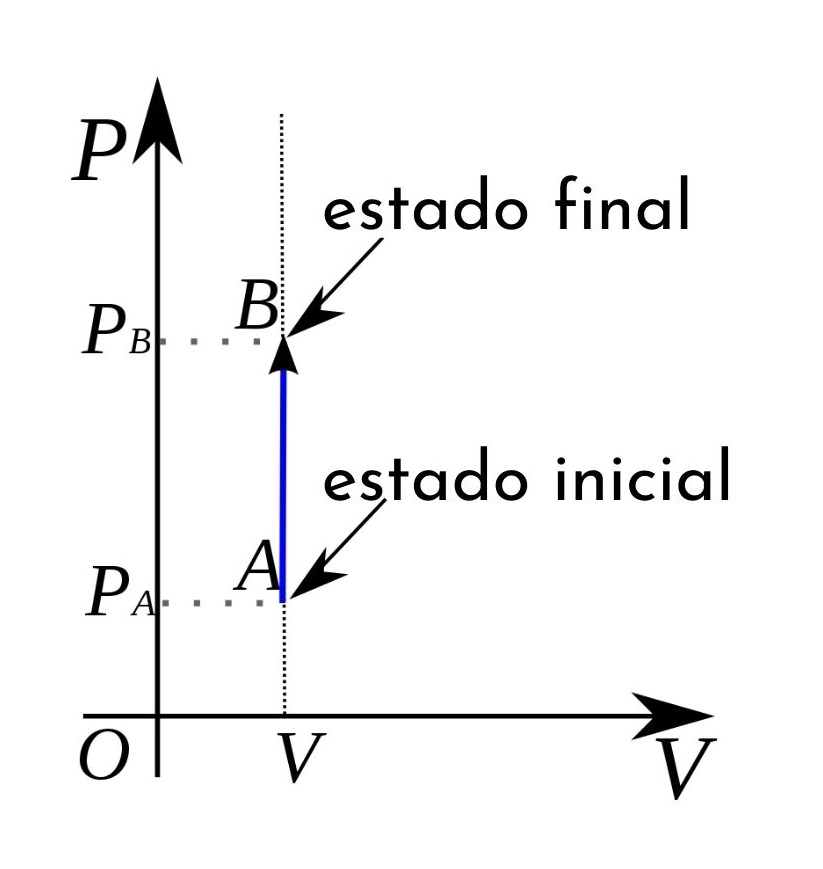
transformación isocórica
donde los valores del sistema
constante
volumen del sistema
V
variable
presión
P
temperatura
T
energía interna
U
pero
variación de volumen nulo
ΔV = 0
no se presenta expansión/contracción
volumen del gas
ΔV = 0
entonces
trabajo realizado por/sobre el sistema nulo
W = 0
resultando
cambio de la energía interna
ΔU = ΔQv
ΔQv
utiliza
masa del sistema
M
calor especifico a volumen constante
cv
variación de temperatura
ΔT
expresada
ΔQv = M cv ΔT
diagrama P - V
Subtopic
Ley Gay Lussac
Va = Vb
Ta <> Tb => Pa / Ta = Pb / Tb
transformación isotérmica
donde los valores del sistema
constante
Temperatura interna
Ti
energía interna
U
variable
presión interna
P
volumen
V
cuando se presenta
expansión
calor absorbido
ΔQ > 0
igual
al trabajo por el sistema
W > 0
contracción
calor expulsado
igual
al trabajo sobre el sistema
W < 0
ΔQ < 0
expresa como
ΔU = ΔQ -W
ΔU = 0
ΔQ = W
diagrama P - V
Ley de Boyle - Mariotte
Ta = Tb
Pa*Va = Pb*Vb
la curva hiperbólica representa el valor de temperatura constante.

transformación adiabática
no existe transferencia de calor
ΔQ = 0
hacia
sistema
aislado térmicamente
o desde
sin embargo
puede existir
intercambio de energia
forma
trabajo mecanico
ΔW
ΔU
la energía interna
puede cambiar
trabajo realizado por el sistema
W > 0
trabajo sobre el sistema
W < 0
expresa como
ΔU = ΔQ -W
ΔU = -W
ΔQ = 0
diagrama P - V
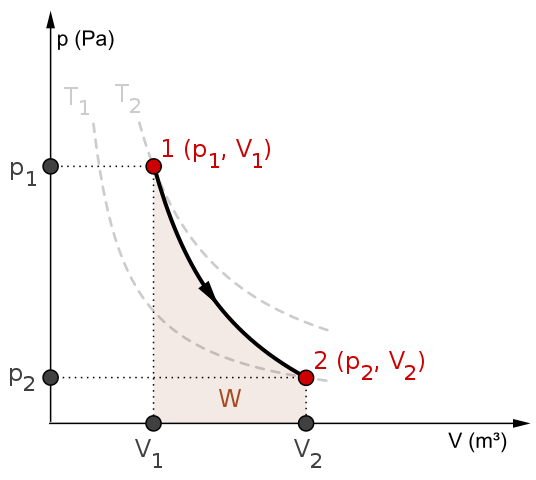
la curva es mas pronunciada y empinada que la isotérmica.
muestra una relación más rápida entre la presión y el volumen.
segunda ley

Formulación de Clausius
basa
concepto de entropía
establece
un sistema aislado
el calor
no puede fluir espontáneamente
de un cuerpo frio
Q2
a un cuerpo caliente
Q1
Q2 < Q1
pero puede fluir en sentido inverso
aplicando un trabajo sobre el fluido
refrigeración
W

Formulación de Kelvin-Planck
basa
concepto de ciclos termodinámicos
establece
es imposible
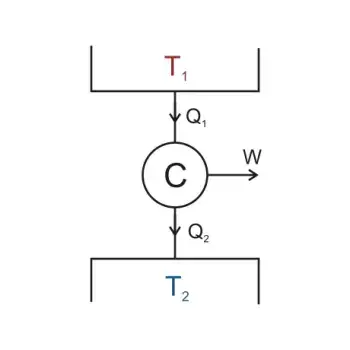
construir un dispositivo
operando un ciclo
extraiga
cantidad neta de calor
Q1
convierta
completamente en trabajo
W
sin ceder alguna parte del calor
Q2
expresa asi
Q1 = W + Q2
Q2 <> 0
Rendimiento
R = T / Q1 = Q1 - Q2 / Q1 = 1 - Q2 / Q1
constituidos por
transformación isobárico
transformación isocórica
transformación isotérmica
transformación adiabática
Tipos
observación
El área delimitada por la ruta completa del ciclo representa el trabajo total que se puede hacer durante un ciclo.
Las curvas hiperbólicas en las graficas representa a la temperatura en las rutas.
Ciclo Carnot
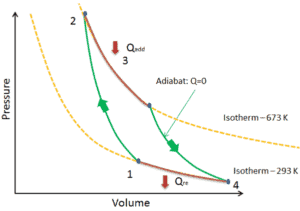
Q12 = 0 ; proceso adiabático; compresión
T1 < T2
P1 < P2
V1 > V2
Q23 <> 0 ; proceso isotérmico; expansión
calor absorbido
T2 = T3
P2 > P3
V2 < V3
Q34 = 0 ; proceso adiabático; expansión
T3 > T4
P3 > P4
V3 < V4
Q41 <> 0 ; proceso isotérmico; compresión
calor cedido
T4 = T1
P4 < P1
V4 > V1
Ciclo Otto
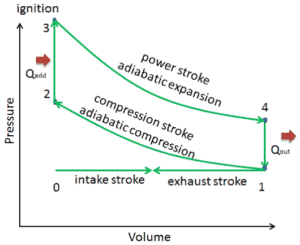
Q12 = 0 ; proceso adiabático; compresión
T1 < T2
P1 < P2
V1 > V2
Q23 <> 0 ; proceso isocórico; invariable
calor absorbido
T2 < T3
P2 < P3
V2 = V3
Q34 = 0 ; proceso adiabático; expansión
T3 > T4
P3 > P4
V3 < V4
Q41 <> 0 ; proceso isocórico; invariable
calor cedido
T4 > T1
P4 > P1
V4 = V1
Ciclo Diesel
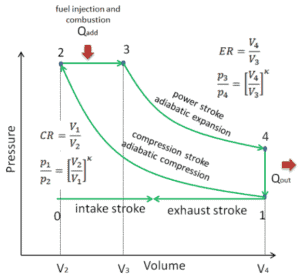
Q12 = 0 ; proceso adiabático; compresión
T1 < T2
P1 < P2
V1 > V2
Q23 <> 0 ; proceso isobárico; expansión
calor absorbido
T2 < T3
P2 = P3
V2 < V3
Q34 = 0 ; proceso adiabático; expansión
T3 > T4
P3 > P4
V3 < V4
Q41 <> 0 ; proceso isocórico; invariable
calor cedido
T4 > T1
P4 > P1
V4 = V1
Ciclo Brayton
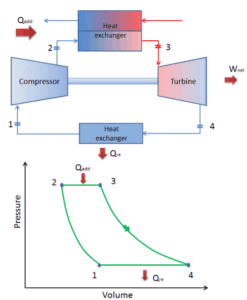
Q12 = 0 ; proceso adiabático; compresión
T1 < T2
P1 < P2
V1 > V2
Q23 <> 0 ; proceso isobárico; expansión
calor absorbido
T2 < T3
P2 = P3
V2 < V3
Q34 = 0 ; proceso adiabático; expansión
T3 > T4
P3 > P4
V3 < V4
Q41 <> 0 ; proceso isobárico; compresión
calor cedido
T4 > T1
P4 = P1
V4 > V1
Ciclo Rankine

Q12 = 0 ; proceso adiabático; expansión
T1 < T2
P1 < P2
V1 < V2
Q23 <> 0 ; proceso isobárico; expansión
calor absorbido
T2 < T3
P2 = P3
V2 < V3
Q34 = 0 ; proceso adiabático; expansión
T3 > T4
P3 > P4
V3 < V4
Q41 <> 0 ; proceso isobárico; compresión
calor cedido
T4 > T1
P4 = P1
V4 > V1
usado
funcionamiento de motores térmicos
tercera ley
Teoría del "calórico"
Siglo XVIII y XIX
cientificos
creían
dos cuerpos diferentes temperaturas
ponen contacto
después de un tiempo
llegaban a una misma temperatura
equilibrio térmico
trasmitían
calorico
sustancia
fluida
invisible
masa nula
del cuerpo mas caliente al mas frio
"Calor es energía"
idea
presentada
Benjamín Thompson
ingeniero militar
trabajaba
fabricación de tubos de cañón
1798
observa
calentamiento de piezas de acero
después
ser perforadas
atribuye esto
trabajo realizado contra la fricción
durante
barrenado
osea
energía empleada
realización de dicho trabajo
era
transmitida
piezas
producia
aumento temperatura
menciona
cuerpo muy caliente
no tiene
mucha cantidad de calorico
sino posee
mayor cantidad de energía en su interior
transcurrir
tiempo
diversos experimentos
confirmaron
suposiciones de Thompson
destacando
James P. Joule
estableciendo definitivamente
el calor es una forma de energía
energía
transmitida
de un cuerpo a otro
de diferentes temperaturas
de una energía externa a un cuerpo
origina un aumento
energía de agitación
moléculas
atomos
conllevando
aumento en la temperatura
energía interna
cuerpos
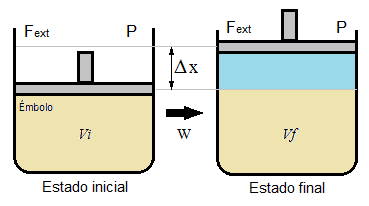
Trabajo en una variación de volumen
cuando exista
diferencia de temperatura
ΔT
cantidad determinada de calor
ΔQ
podrá ser
transferida
de uno a otro
entre
sistema
vecindad
un contenedor con gas (pistón)
podría resultar dos casos
volumen del sistema
expanda
ΔV = Vf - Vi > 0
debido
presión externa menor a la interna
ΔP = Pe - Pi < 0
realiza
trabajo positivo
W > 0
trabajo fue realizado por el sistema
Pi constante
Fi constante
constante
transformación isométrica
W = 0
retraiga
debido
presión externa mayor a la interna
ΔP = Pe - Pi > 0
realiza
trabajo negativo
W < 0
trabajo fue realizado sobre el sistema
Pi constante
Fi constante
ΔV = Vf - Vi < 0
donde
un objeto(embolo) en movimiento con área definida
A
es afectado
fuerza neta
ΔF
recorre una distancia
d
resultando
trabajo realizado
W = ΔF d = ΔP A d = ΔP ΔV
esta involucrado
magnitudes/propiedades físicas
Calor especifico
tipos
Calor específico a presión constante (cp)
muy utilizado
sustancias
fase gaseosa
presión constante
Calor específico a volumen constante (cv)
muy utilizado
sustancia
fase sólida
fase liquida
volumen constante
representa
cantidad de calor
requiere
elevar temperatura
△Q
en una unidad de masa
m
en una unidad de temperatura
△T
formula con
c = C/m = △Q/△T m
unidad
cal/g °C
J/g °C
varia
según el tipo de material
Aluminio
c = 0.22 cal / g °C
Vidrio
c = 0.20 cal / g °C
estado físico
como
agua
acuosa
c = 1 cal / g °C
hielo
c = 0.55 cal / g °C
vapor
c = 0.50 cal / g °C
Capacidad térmica
utilizado
reacciones químicas
diseño de sistemas
calefacción
refrigeración
tipos
Capacidad térmica a presión constante (Cp)
muy utilizado
sustancias
fase gaseosa
presión constante
Capacidad térmica a volumen constante (Cv)
volumen constante
muy utilizado
sustancias
fase sólida
fase líquida
representa
cantidad de calor
que puede
absorver/liberar un cuerpo
△Q
durante
un cambio de temperatura
en un proceso
calentamiento
enfriamento
△T
formula con
C= △Q/△T
puede variar
rango de temperaturas
por ello
considera
Capacidad térmica media
material
diferentes masas
m2
△T2
m1
△T1
mismo calor (△Q)
unidad
cal/°C
J/°C
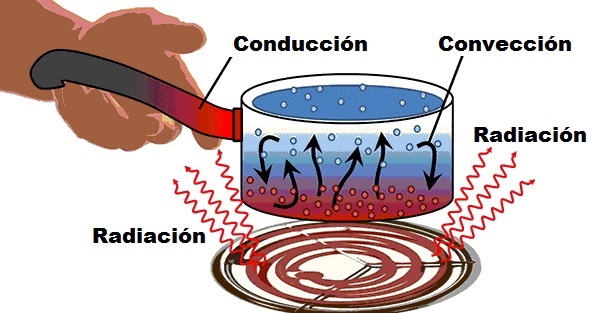
Transmisión del Calor
Conducción
transmisión
por medio
material solido
entre objetos
consiste
trasmisión por vibración/agitación sucesiva
moléculas mas calientes
moléculas mas frías

conducción térmica
ejemplos conductores
buenos
metales
malos
unicel
corcho
porcelana
madera
aire
hielo
lana
papel
no existe
translación de partículas
interior del cuerpo
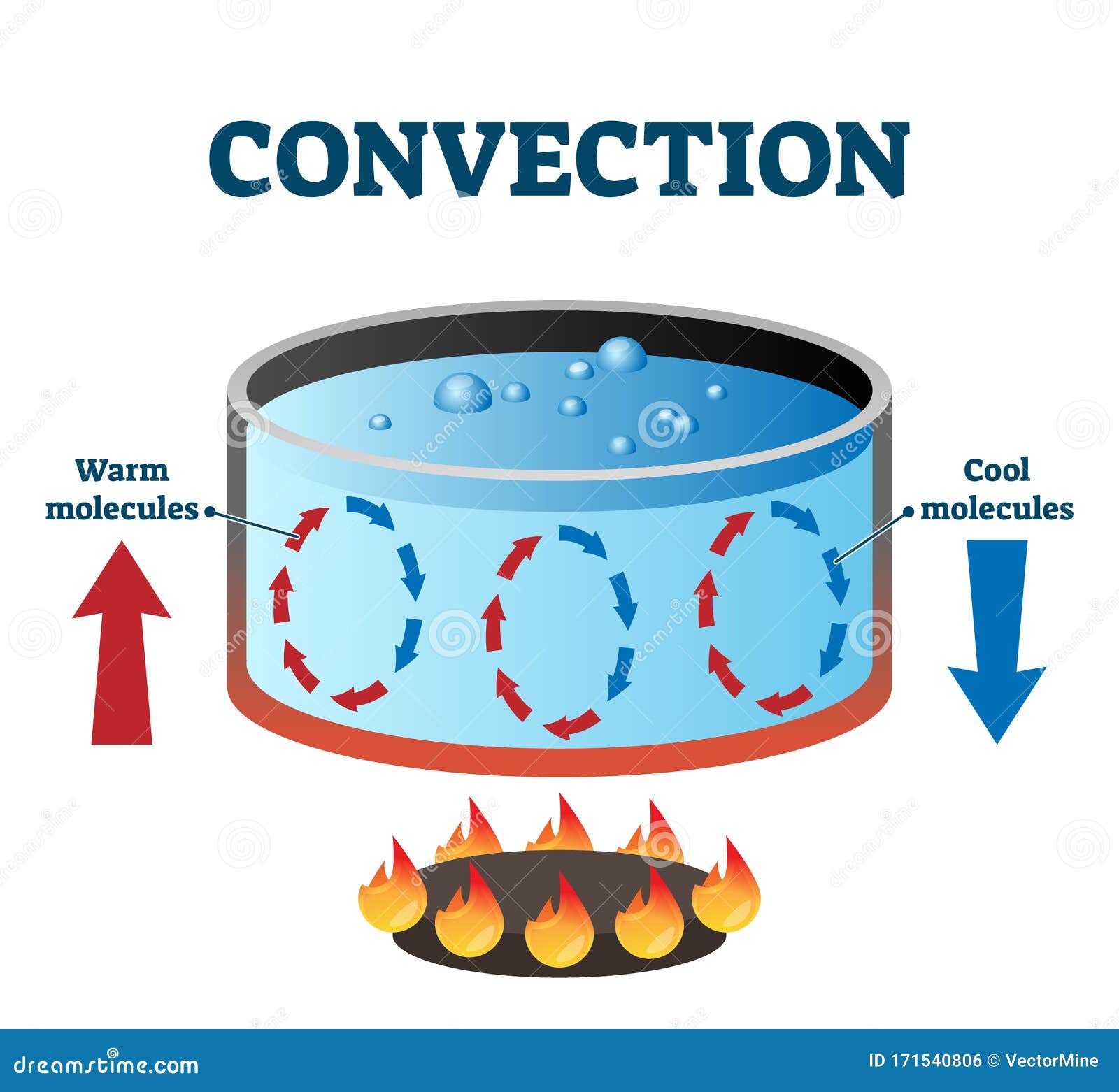
Convección
transmisión
por medio
fluido
aire
agua
consiste
translación por circulación
moléculas mas calientes
hacia la parte superior
moléculas mas frías
hacia la parte inferior
existe
translación de partículas
interior del cuerpo
Radiacción
transmisión
no requiere
medio material
transferencia de calor
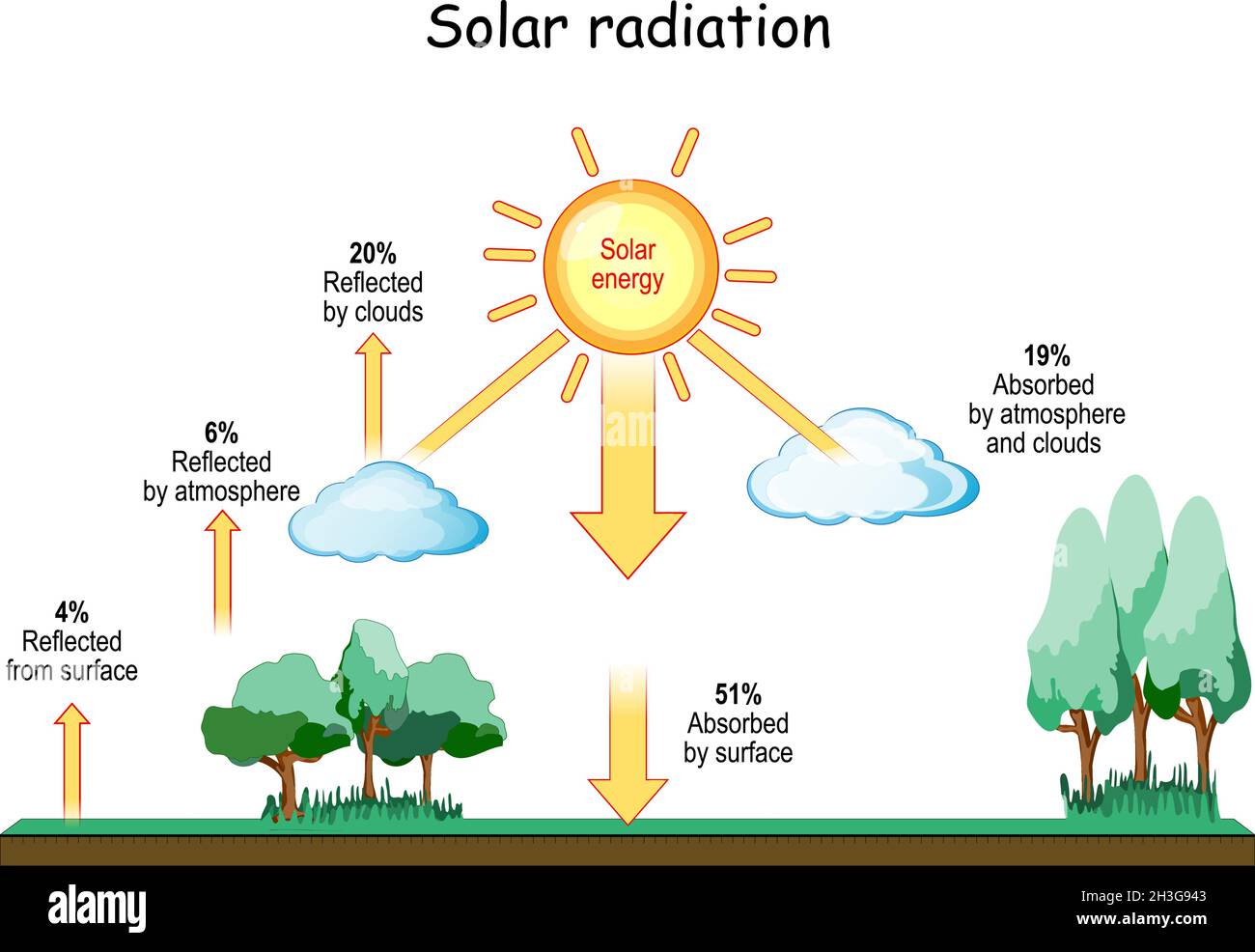
radiación térmica
entra en contacto a un cuerpo
presenta 2 escenarios
Absorción
aumento de temperatura
cuerpos oscuros
Reflexión
cuerpos claros
dependiendo
propiedades del objeto
condiciones especificas del sistema
muy emitidas
cuerpos calientes
osea
vacío
consiste
emisión y absorción de energia
en forma de ondas electromagnéticas
Luz Infrarroja
unidad de medida
Joules (J)
Caloría (Cal)
1 cal = 4.18 J