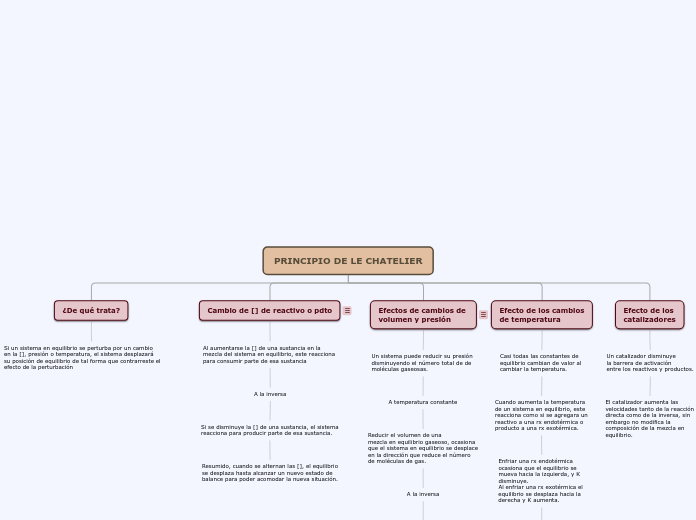
PRINCIPIO DE LE CHATELIER
¿De qué trata?
Si un sistema en equilibrio se perturba por un cambio
en la [], presión o temperatura, el sistema desplazará
su posición de equilibrio de tal forma que contrarreste el efecto de la perturbación
Cambio de [] de reactivo o pdto
Al aumentarse la [] de una sustancia en la
mezcla del sistema en equilibrio, este reacciona
para consumir parte de esa sustancia
A la inversa
Si se disminuye la [] de una sustancia, el sistema
reacciona para producir parte de esa sustancia.
Resumido, cuando se alternan las [], el equilibrio
se desplaza hasta alcanzar un nuevo estado de
balance para poder acomodar la nueva situación.
Efectos de cambios de
volumen y presión
Un sistema puede reducir su presión
disminuyendo el número total de de
moléculas gaseosas.
A temperatura constante
Reducir el volumen de una
mezcla en equilibrio gaseoso, ocasiona
que el sistema en equilibrio se desplace
en la dirección que reduce el número
de moléculas de gas.
A la inversa
Aumentar el volumen ocasiona un
desplazamiento en la dirección que
produce más moléculas de gas.
Efecto de los cambios
de temperatura
Casi todas las constantes de
equilibrio cambian de valor al
cambiar la temperatura.
Cuando aumenta la temperatura
de un sistema en equilibrio, este
reacciona como si se agregara un
reactivo a una rx endotérmica o
producto a una rx exotérmica.
Enfriar una rx endotérmica
ocasiona que el equilibrio se
mueva hacia la izquierda, y K
disminuye.
Al enfriar una rx exotérmica el
equilibrio se desplaza hacia la
derecha y K aumenta.
En resumen, el equilibrio se
desplaza en la dirección en que
consume al reactivo o producto
en exceso, es decir, el calor.
Efecto de los
catalizadores
Un catalizador disminuye
la barrera de activación
entre los reactivos y productos.
El catalizador aumenta las
velocidades tanto de la reacción
directa como de la inversa, sin
embargo no modifica la
composición de la mezcla en
equilibrio.