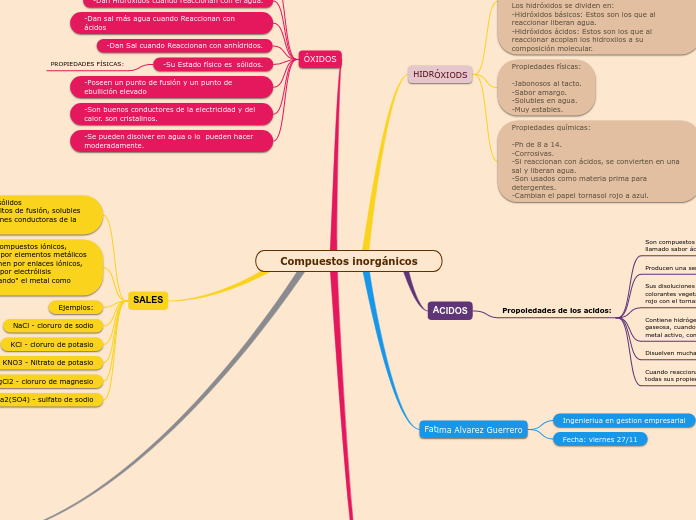
Un hidróxido es un tipo de compuesto químico cuya principal característica es que combina un metal con un hidroxilo (OH) y el proceso libera agua, esto debido al enlace formado por el metal.
Los hidróxidos se dividen en:
-Hidróxidos básicos: Estos son los que al reaccionar liberan agua.
-Hidróxidos ácidos: Estos son los que al reaccionar acoplan los hidroxilos a su composición molecular.
Propiedades físicas:
-Jabonosos al tacto.
-Sabor amargo.
-Solubles en agua.
-Muy estables.
Propiedades químicas:
-Ph de 8 a 14.
-Corrosivas.
-Si reaccionan con ácidos, se convierten en una sal y liberan agua.
-Son usados como materia prima para detergentes.
-Cambian el papel tornasol rojo a azul.
Propoiedades de los acidos:
Son compuestos que tienen un sabor agrio típico, llamado sabor ácido.
Producen una sensación punzante en contacto con la piel.
Sus disoluciones acuosas cambian el color de muchos colorantes vegetales; por ejemplo, producen un color rojo con el tornasol (azul).
Contiene hidrógeno que puede liberarse, en forma gaseosa, cuando a sus disoluciones acuosas se añade un metal activo, como, por ejemplo, cinc.
Disuelven muchas sustancias.
Cuando reaccionan con hidróxidos metálicos, pierden todas sus propiedades características.
Ingenieriua en gestion empresarial
Fundamentos Dr Quimica
Fecha: viernes 27/11
-Producen iones dando el catión metálico y el anión óxido.
PROPIEDADES QUIMICAS
-Dan Hidróxidos cuando reaccionan con el agua.
-Dan sal más agua cuando Reaccionan con ácidos
-Dan Sal cuando Reaccionan con anhídridos.
-Su Estado físico es sólidos.
PROPIEDADES FÍSICAS:
-Poseen un punto de fusión y un punto de ebullición elevado
-Son buenos conductores de la electricidad y del calor. son cristalinos.
-Se pueden disolver en agua o lo pueden hacer moderadamente.
Propiedades físicas: son sólidos cristalinos,quebradizos, altos de fusión, solubles en agua y forman soluciones conductoras de la corriente eléctrica.
Propiedades químicas: compuestos iónicos, generalmente formados por elementos metálicos y no metálicos que se unen por enlaces iónicos, pueden descomponerse por electrólisis (generalmente "recuperando" el metal como sustancia simple)
Ejemplos:
NaCl - cloruro de sodio
KCl - cloruro de potasio
KNO3 - Nitrato de potasio
MgCl2 - cloruro de magnesio
Na2(SO4) - sulfato de sodio
Por lo general los hidruros son compuestos estequiométricos que presentan propiedades metálicas como por ejemplo la conductividad. Tienen una gran velocidad de difusión del hidrógeno por medio del sólido cuando se someten a temperatura elevadas.
Los hidruros salinos por lo general se encuentran en estado sólido y son de color blanco o gris. Este tipo de hidruro se puede obtener por medio de reacciones directas del metal con el hidrógeno.
Elementos como el fósforo, arsénico y sus compuestos son considerados tóxicos. Tienen agentes reductores bastante efectivos y no reaccionan con el agua o con los ácidos catalogados como no oxidantes.