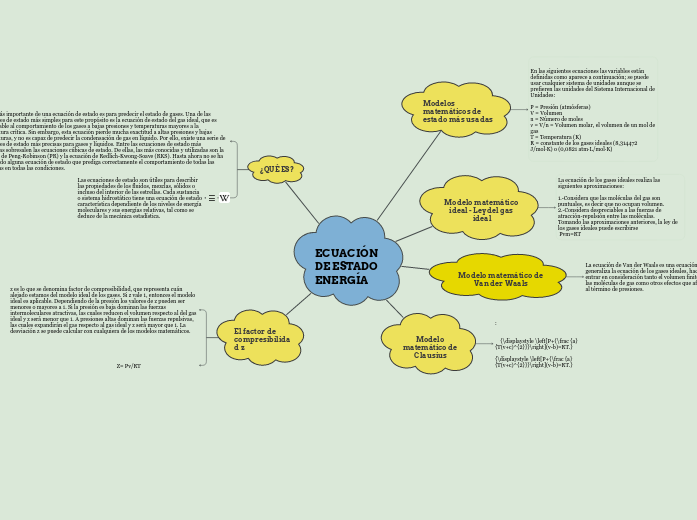
ECUACIÓN DE ESTADO ENERGÍA
Modelos matemáticos de estado más usadas
Modelo matemático ideal - Ley del gas ideal
La ecuación de los gases ideales realiza las siguientes aproximaciones:
1.-Considera que las moléculas del gas son puntuales, es decir que no ocupan volumen.
2.-Considera despreciables a las fuerzas de atracción-repulsión entre las moléculas.
Tomando las aproximaciones anteriores, la ley de los gases ideales puede escribirse
Pvm=RT
Modelo matemático de Van der Waals
La ecuación de Van der Waals es una ecuación que generaliza la ecuación de los gases ideales, haciendo entrar en consideración tanto el volumen finito de las moléculas de gas como otros efectos que afectan al término de presiones.
Modelo matemático de Clausius
:
{\displaystyle \left[P+{\frac {a}{T(v+c)^{2}}}\right](v-b)=RT.}
{\displaystyle \left[P+{\frac {a}{T(v+c)^{2}}}\right](v-b)=RT.}
¿QUÉ ES?
El uso más importante de una ecuación de estado es para predecir el estado de gases. Una de las ecuaciones de estado más simples para este propósito es la ecuación de estado del gas ideal, que es aproximable al comportamiento de los gases a bajas presiones y temperaturas mayores a la temperatura crítica. Sin embargo, esta ecuación pierde mucha exactitud a altas presiones y bajas temperaturas, y no es capaz de predecir la condensación de gas en líquido. Por ello, existe una serie de ecuaciones de estado más precisas para gases y líquidos. Entre las ecuaciones de estado más empleadas sobresalen las ecuaciones cúbicas de estado. De ellas, las más conocidas y utilizadas son la ecuación de Peng-Robinson (PR) y la ecuación de Redlich-Kwong-Soave (RKS). Hasta ahora no se ha encontrado alguna ecuación de estado que prediga correctamente el comportamiento de todas las sustancias en todas las condiciones.
Las ecuaciones de estado son útiles para describir las propiedades de los fluidos, mezclas, sólidos o incluso del interior de las estrellas. Cada sustancia o sistema hidrostático tiene una ecuación de estado característica dependiente de los niveles de energía moleculares y sus energías relativas, tal como se deduce de la mecánica estadística.
El factor de compresibilidad z
z es lo que se denomina factor de compresibilidad, que representa cuán alejado estamos del modelo ideal de los gases. Si z vale 1, entonces el modelo ideal es aplicable. Dependiendo de la presión los valores de z pueden ser menores o mayores a 1. Si la presión es baja dominan las fuerzas intermoleculares atractivas, las cuales reducen el volumen respecto al del gas ideal y z será menor que 1. A presiones altas dominan las fuerzas repulsivas, las cuales expandirán el gas respecto al gas ideal y z será mayor que 1. La desviación z se puede calcular con cualquiera de los modelos matemáticos.