Metabolismo de aminoacidos
Perdida del grupo Amino
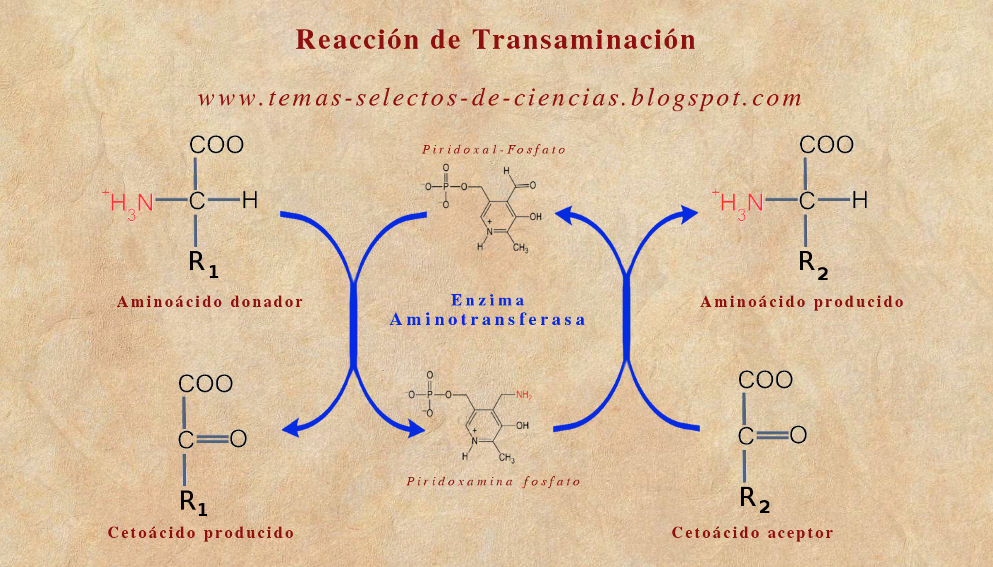
Transaminacion
Catalizada por la enzima aminotransferasa
Grupo a-amino de un AA se transfiere al grupo carbonilo de a-cetoacido
AA dador pasa a a-cetoacido y el a-cetoacido aceptor del grupo amino se transforma en un AA
Aceptores de grupos amino
Aspartato
Glutamato
Reacciones reversibles
Todas las transaminasas requieren fosfato piridoxal como grupo prostético
Glutamato-oxalacetato
aminotransfersas(GOT) en plasma, es un índice de lesion hepatica
Alanina
Desaminacion oxidativa
El glutamato pierde el grupo amino y el carbono α se oxida a carbónico, dando α -cetoglutarato
Glutamato deshidrogenasa es una enzima alosterica sujeta a control inhibitorio por GTP y estimuladores por ADP
La acción combinada de transaminasas y glutamato deshidrogenasa se conoce como transdesaminacion

Rutas metabólicas específicas de aminoácidos
Glucogénesis
Síntesis de glucógeno a partir de glucosa-6-fosfato
Estímulada por la hormona insulina
Cetogénesis
Se forman cuerpos cetonicos en el higado por la oxidacion de acidos grasos
Disminuye oxalacetato
Síntesis de proteínas
Requiere una molécula de ARN mensajero como intermediario
Los ribosomas son los encargados de hacer realidad la síntesis de proteínas.
Etapas
Transcripción
Empalme de ARN
Traducción
Acoplamiento
Decodificación
Elongación
Finalización
Reutilización de aminoácidos
Recuperación de aminoácidos en el intestino
Los AA se transportan por las celulas del intestino, ingresan al torrente sanguíneo
Recaptación de aminoácidos por las células
Transportadores específicos captan AA
Síntesis proteica
Los aminoácidos recuperados y los sintetizados a partir de precursores son utilizados en la síntesis de nuevas proteínas en las células
Transaminación y desaminación reversible
Ciclo de la urea
Enfermedades metabólicas relacionadas con los aminoácidos
Alcaptonuria
Acumulación de homogentisato debido a la deficiencia de homogentisato dioxigenasa (HGD)

Fenilcetonuria (PKU)
Incapacidad para metabolizar fenilalanina.

Aminoácidos
Esenciales
Se obtienen de la dieta
El cuerpo no los sintetiza
Arginina
Isoleucina
Leucina
Valina
Lisina
No esenciales
El cuerpo puede producirlos a partir de otros compuestos
Alanina
Asparagina
Gutamina
Prolina
Serina

Reacciones de fijacion del grupo amino
Sintesis de glutamato
A partir de a-cetoglutarato
usa amonio y oxida NADPH o NADH
Sintesis de glutamina
Enzima glutamina sintetasa
Rotura con liberacion de glutamato y amoniaco en riñon
Catalizado por glutaminasa
Sintesis de alanina
Musculo
Formacion de alanina a partir de piruvato y glutamato
Enzima alanina amino transfersa
Sintesis de Urea
Urea producto final no toxico de la eliminacion de nitrogeno
Ciclo de la urea
El amoniaco se une con el bicarbonato y forma carbamoil-fosfato catalizado por carbamoil-fosfato sintetasa I
La enzima cede su grupo carbamilo a la ornitina
Se forma citrulina y se libera fosfato, catalizado por la ornitina carbamoil transferasa
El aspartato se forma en la mitocondria por transaminacion del oxalacetato
Ornitina, citrulina y arginina no sufren ganancia ni perdida neta
El amoniaco y el bicarbonato se consumen
Se usan 4 uniones fosfato de alta energia

Destino de los esqueletos carbonados de los aminoacidos
Se pierde el grupo amino, los esqueletos carbonados resultantes de los AA son canalizados hacia el ciclo de Krebs para su degradación
Piruvato, acetiICoA, acetoacetato, a-cetoglutarato, succiniICOA, fumarato y oxalacetato
Intermediarios del ciclo de Krebs pueden ser utilizados para
la síntesis de aminoácidos no esenciales
los aminoácidos se clasifican en cetogénicos y glucogénicos
Cetogénicos
Se degradan a acetilCOA O a acetoacetilCOA
glucogénicos
Se degradan a piruvato, a-cetoglutarato,
succinilCoA, glutamato u oxalacetato