LEZIONE DI SCIENZE: ATOMI E MOLECOLE in una classe prima della scuola secondaria di primo grado composta da 18 alunni. Nella classe è presente Marco, uno studente con ASD e disabilità intellettiva lieve
FASI OPERATIVE
PROGETTAZIONE DELLA LEZIONE
FASE 1:la lezione

BRAINSTORMING (10 minuti)
Cosa vi viene in mente con la parola "molecola"?
I ragazzi esprimono le loro idee e Marco le annota sulla lavagna ( oppure un altro compagno che si propone)
VISIONE DI UN VIDEO ATTRAVERSO UTILIZZO DELLA LIM PRESENTE IN CLASSE
Spiegazione orale
Struttura atomi: neutroni ,protoni ed elettroni
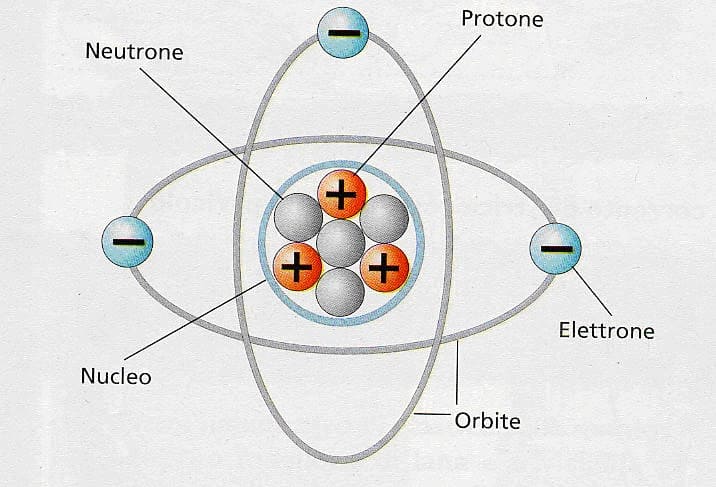
Numero atomico e numero di massa

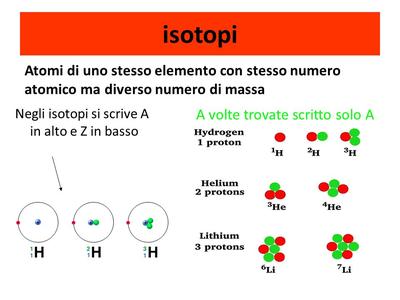
Isotopi
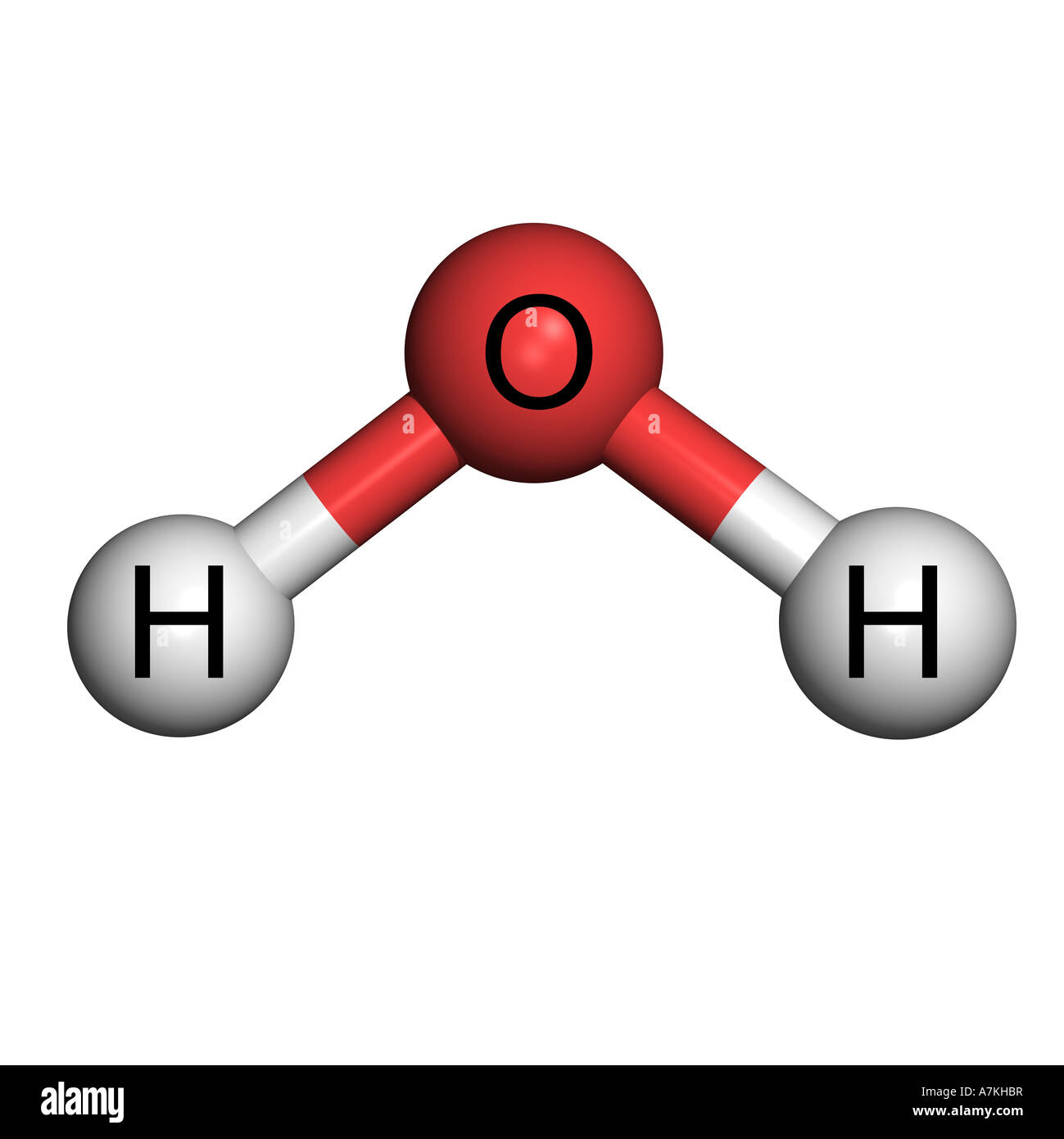
Molecole
UTILIZZO DI MAPPE CONCETTUALI

FASE 2: Cooperative learning

Mettiamoci all'opera: esercizio pratico! La classe viene suddivisa in tre gruppi ed insieme svolgeranno gli esercizi assegnati dal docente.

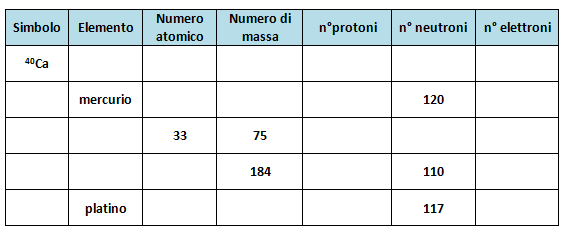
FASE 3: attività laboratoriale

I ragazzi verranno accompagnati nel laboratorio di scienze presente nella scuola dove andranno a creare un modellino 3D della molecola di acqua
FASE 4: la prossima lezione
Gli studenti dovranno consolidare le conoscenze acquisite durante la lezione sul libro di testo e svolgere gli esercizi scelti dal docente.
FASE 5: la verifica
Il docente somministrerà un quiz a risposta multipla tramite la piattaforma Kahoot. Ogni alunno svolgerà la prova accedendo dal proprio dispositivo elettronico ( tablet o cellulare)
VERIFICA
KAHOOT
WORDWALL
PREREQUISITI
-Utilizzo di supporti tecnologici ; -Nozioni di spazio e di volume ; - Interpretare alcuni fenomeni sul piano
microscopico e su quello macroscopico;
-Sapere cosa si intende per unità strutturale e conoscere i diversi tipi di unità strutturali corrispondenti alle sostanze semplici e composte;
-Avere una certa famigliarità con i simboli che si usano per rappresentare gli elementi chimici.
OBIETTIVI E FINALITA'
Acquisizione di conoscenze sull'argomento trattato
Suscitare interesse e curiosità degli alunni
Incrementare l'inclusione, la cooperazione e la socializzazione
Favorire un apprendimento efficace attraverso il learning by doing
Stimolare la creatività e la motivazione degli studenti
Far emergere conoscenze pregresse e agganciare i nuovi contenuti
Stimolare lo sviluppo di competenze
STRUMENTI ED AMBIENTI DI APPRENDIMENTO
Aula della classe
Laboratorio di scienze
LIM
Libro di testo
Dispositivi elettronici ( tablet o cellulare)
Mappe concettuali
METOLOGIE E STRATEGIE
Brainstorming
Visione di un video con l'utilizzo della LIM per rendere la lezione più interattiva e coinvolgente
Cooperative learning: organizzazione in piccoli gruppi per lo svolgimento di attività per favorire il lavoro di squadra e la partecipazione attiva della classe
Spiegazione orale ed utilizzo di mappe visive
Didattica laboratoriale
TEMPI
Due ore di lezione
Primi 10 minuti di brainstorming
45 minuti dedicati allo studio dell'argomento
20 minuti di lavoro di gruppi
45 minuti in laboratorio