Demócrito
Teoría atómica del universo
El átomo es solido y sin
estructura interna
El primer modelo atómico
postulado por el filósofo
griego Demócrito
Definió al átomo como la partícula diminuta
que no puede ser divisible en otras
más pequeñas que puede tener cualquier
forma, es densa y rellena de materia

V a.C
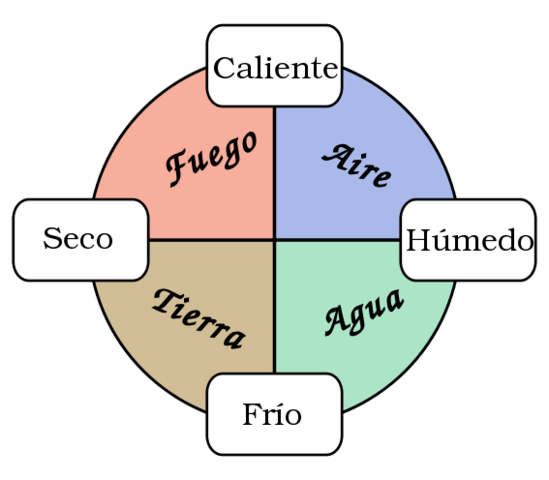
Aristóteles
El centro del universo coincide
con el centro de la Tierra
Cualquier tipo de materia se
llegaría siempre al átomo,
una partícula indivisible
La materia era discontinua
y que estaba formada por
la unión de partículas
diminutas.
(aire, agua, tierra y fuego)
Están sujetos a movimientos naturales,
V a.C
Dalton
Representa al átomo como
la partícula más pequeña e
indivisible de la materia
Los átomos de elementos
distintos se distinguen entre
sí por su peso
El peso atómico de un elemento
permanece constante
Fue el primer modelo
atómico con bases
científicas
Ley de las proporciones
múltiples
Átomos iguales se unen
para formar elementos
1808
Thomson
También conocido como
el modelo del pudín
Definió al átomo como una gran
bola densa de materia con carga
positiva que tenía incrustada
pequeños corpúsculos negativos
y que la suma de estos,
era igual a la carga positiva
Descubrió el electrón en 1897
La carga positiva y negativa es
igual en magnitud
Para tener átomos con carga neutra,
los electrones deberían estar inmersos
en una sustancia con carga positiva
Se consideraba como una
esfera con carga positiva
con electrones repartidos
como pequeños gránulos

1904
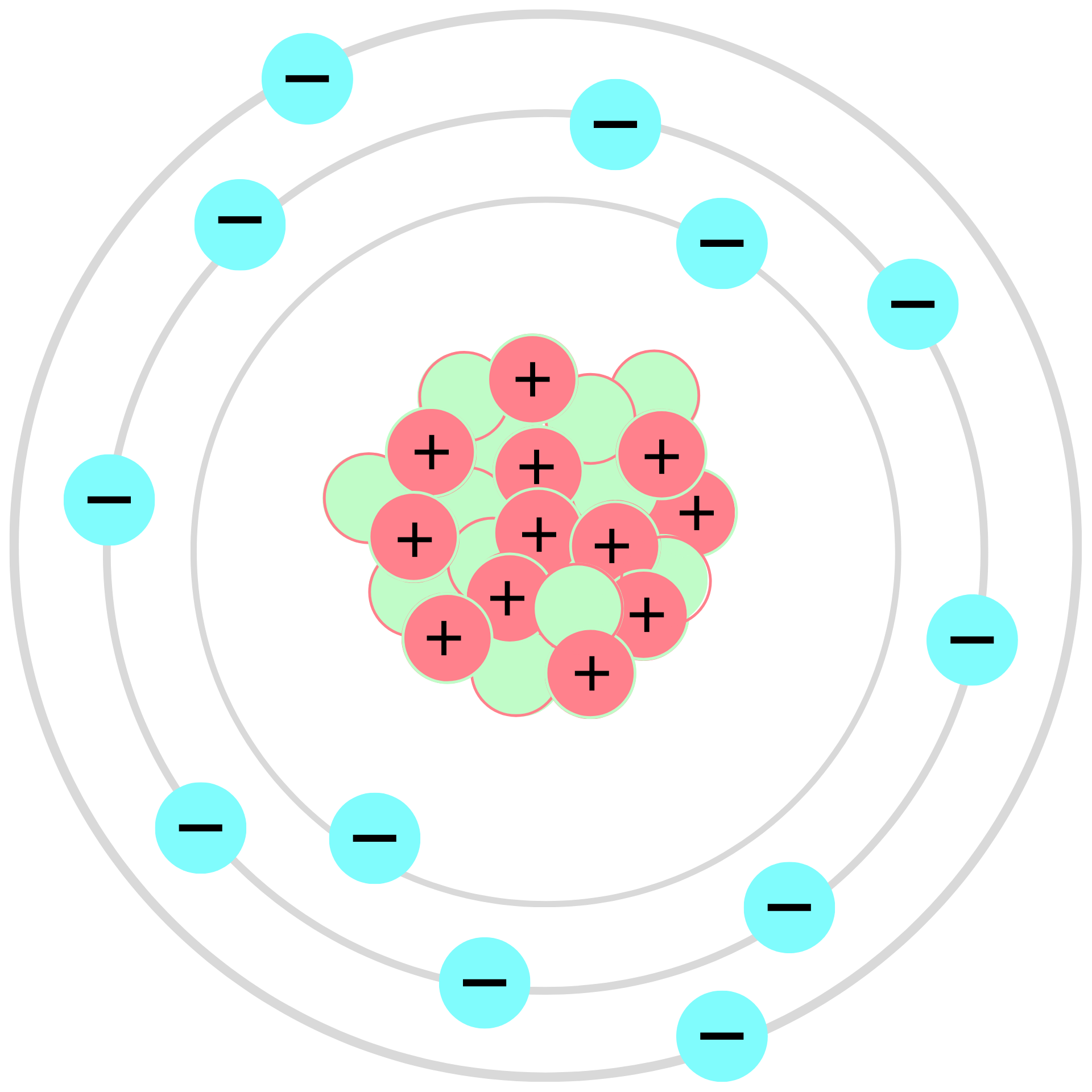
Rutherford
Distingue entre el núcleo central
y una orbita de electrones a su
alrededor
Ernest Rutherford (1871- 1937)
El átomo tenía un centro positiva
y que en torno se desplazaban
diminutos electrones en un espacio
casi vacío, determinó que los
protones eran igual al número
de electrones y a esto lo llamó
número atómico.
Los electrones giran
alrededor del núcleo
La masa del átomo está
concentrada en el núcleo
El átomo esta formado por dos
partes: núcleo y corteza

Bohr
Fue una modificación
al modelo Rutherford
Niels Bohr (1885-1962)
Habla de la capacidad de reacción
Establece las capas de nivel máximas,
descubriendo así las órbitas
Se describía un núcleo central pequeño
y con la mayoría de la masa se mantenía
Los electrones orbitaban
alrededor del núcleo similar a los planetas
Determinó la masa y velocidad del
electrón, así como el sentido en el que giran
Las órbitas tienen un número determinado de electrones
Cúbico de Lewis
Propuesto por el fisicoquímico
estadounidense Gilbert Newton Lewis
Los electrones del átomo estaban
situados en los ocho vértices de un cubo
Introdujo el concepto del par
de electrones en el enlace covalente
La forma cúbica es la única
que permite las diversas
combinaciones entre átomos
(1875-1946)

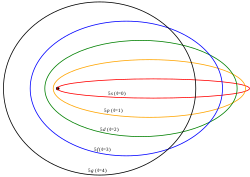
Sommerfeld
Modificó el modelo de Bohr
postulando el número
cuántico azimutal.
Arnold Sommerfeld
Sommerfeld plantea que en
cada nivel donde se encuentran
los electrones hay una serie de
subniveles
Este modelo es del año 1916
Solamente lograba explicar
el átomo de hidrógeno
las órbitas o capas de estos
electrones no son uniformes.
Mientras algunas son circulares,
otras son elípticas
En lugar de electrones orbitando
en su alrredor hay una serie de capas
Schrödinger
Eliminó el concepto
de los electrones como
esferas diminutas.
Erwin Schrödinger en 1926
los electrones podían movilizarse
alrededor del núcleo como
ondas estacionarias
Describió el movimiento de los
electrones con una ecuación
los números cuánticos que se
derivan de una ecuación de
cálculo de Schrödinger se le
llama mecánica cuántica
.png)
Cuántico
Los aportes de tres científicos
Erwin Schrödinger
(1887-1961)
Este átomo acepta la
imposibilidad de
saber exactamente la
ubicación de un electrón
Se considera que este se desplaza
tan rápido, y con tal liberan de energía
Louis de Broglie
(1892-1987)
Ya no se acepta que hay órbitas de
electrones en derredor del núcleo
se considera que los electrones
se mueven una velocidad
muy similar a la de la luz

Werner Heisenberg
(1901-1976)
No hay una certeza absoluta
del ubicación de tales electrones
Se debe tener en cuenta
las leyes de la relatividad