MADDE VE ÖZELLİKLERİ

MADDE NEDİR?
Madde: uzayda yer kaplayan ve saklanan her şey.
Tüm canlılar, cansız varlıklar ve enerji sistemleri maddeden oluşur.
MADDE HALLERİNİN ÖZELLİKLERİ:
Katı Hal:
Tanecikler sık ve düzenlidir.
Belirli bir şekli ve hacmi vardır.
Sıkıştırılamaz.
Örnekler: Taş, demir, buz, kitap.
Sıvı Hal: Tanecikler arası boşluk katılardan fazladır, düzensizdir.
Belirli hacmi vardır ama şekli yoktur; kabın şeklini alır.
Akışkandır.
Örnekler: Su, süt, alkol, yağ.
Gaz Hal: Tanecikler çok düzensiz ve serbesttir.
Şekli ve hacmi yoktur, bulundukları ortamı tamamen doldurur.
Sıkıştırılabilir.
Örnekler: Hava, oksijen, karbondioksit.
Plazma Hal: Yüksek enerjiye sahip, iyonize gazlardır. Örneğin; Güneş, yıldızlar.
MADDEYİ TANIMLAYAN TEMEL ÖZELLİKLER:
Kütle: Maddenin miktarıdır. Terazide ölçülür.
Birimi: gram (g) ya da kilogram (kg).
Örnek: 1 litre suyun kütlesi yaklaşık 1 kg’dır.
Hacim: Maddenin kapladığı üç boyutlu alan.
Katılar: cm³ veya m³, Sıvılar: Litre (L) veya mililitre (ml)
Örnek: 1 su bardağının hacmi yaklaşık 200 ml'dir.
Yoğunluk: Bir maddenin birim hacmindeki kütlesi:
Yoğunluk = Kütle / Hacim
Örnek: Su → 1 g/cm³, Cıva → 13.6 g/cm³ → Cıva suyun dibine batar.
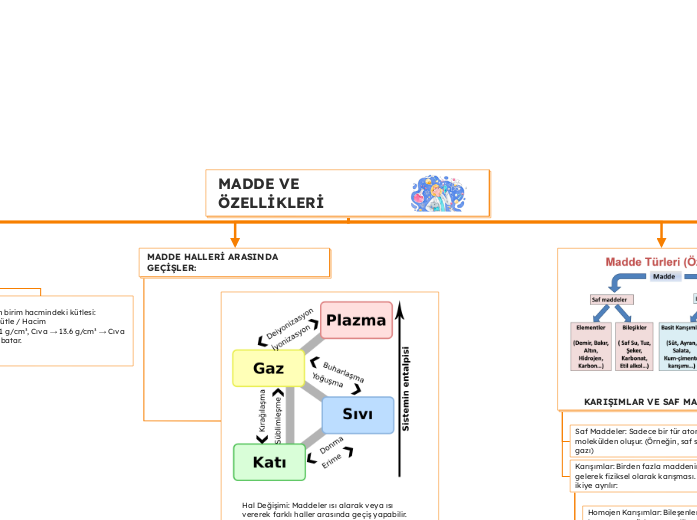
MADDE HALLERİ ARASINDA GEÇİŞLER:

Hal Değişimi: Maddeler ısı alarak veya ısı vererek farklı haller arasında geçiş yapabilir. Bu geçişler fiziksel değişimlerdir, yani maddenin kimyasal yapısı değişmez, sadece fiziksel hali değişir.
ISI ALARAK GERÇEKLEŞEN GEÇİŞLER:
Erime: Katı → Sıvı
Katı bir madde ısı aldıkça tanecikleri hareketlenir ve düzen bozulur, sıvı hale geçer.
Örnek: Buz → Su (0°C'de erir).
Buharlaşma: Sıvı → Gaz Sıvı yüzeyinden gaz haline geçiştir. Her sıcaklıkta olabilir.
Örnek: Su → Su buharı
Kaynama: Sıvı → Gaz Sıvının her noktasından (iç-dış) buharlaşmasıdır. Belirli sıcaklıkta gerçekleşir.
Örnek: Su, 100°C'de kaynar.
Süblimleşme: Katı → Gaz
Bazı katı maddeler doğrudan gaz hale geçer, arada sıvı olmaz.
Örnek: Naftalin, kuru buz (katı CO₂).
ISI VEREREK GERÇEKLEŞEN GEÇİŞLER:
Donma: Sıvı → Katı
Sıvı soğudukça taneciklerin hareketi azalır, düzenli hale gelir ve katılaşır.
Örnek: Su → Buz
Yoğunlaşma: Gaz → Sıvı Gaz tanecikleri soğuyarak bir araya gelir ve sıvıya dönüşür.
Örnek: Su buharı → su damlası (soğuk cam yüzeyde buğu).
Kırağılaşma: Gaz →Katı Gaz maddeler doğrudan katı hale geçer, sıvı hale uğramadan.
Örnek: Su buharının soğukta doğrudan buz kristali olarak çökelmesi (kırağı oluşumu).
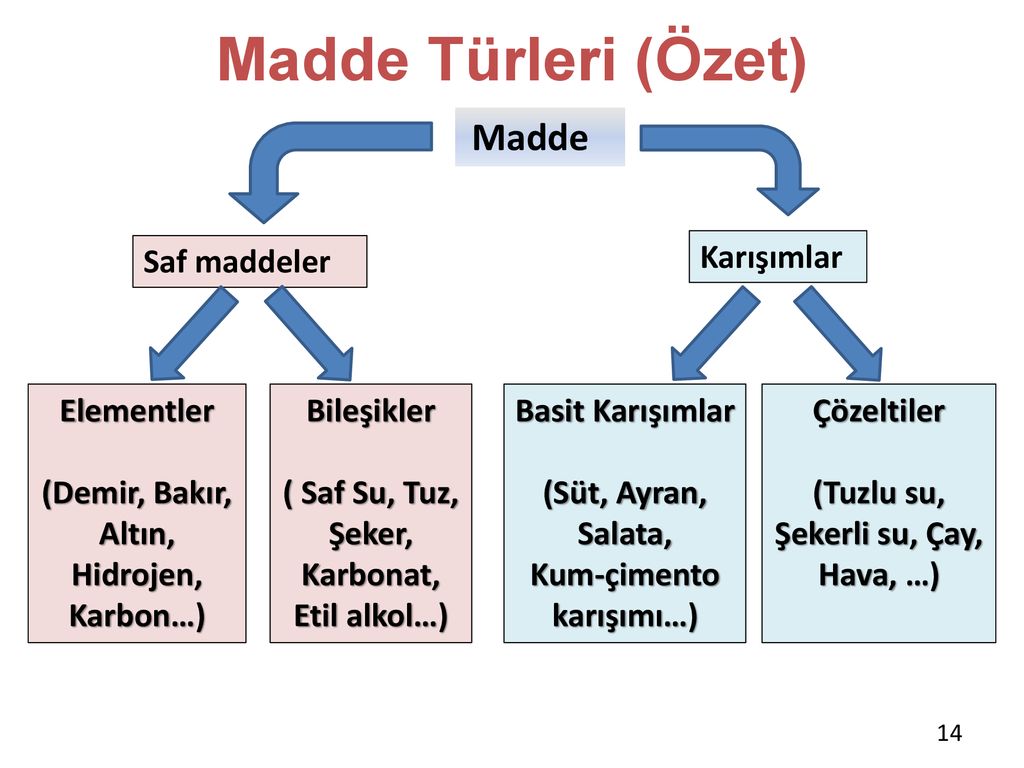
KARIŞIMLAR VE SAF MADDELER:
Saf Maddeler: Sadece bir tür atom veya molekülden oluşur. (Örneğin, saf su, oksijen gazı)
Karışımlar: Birden fazla maddenin bir araya gelerek fiziksel olarak karışması. Karışımlar ikiye ayrılır:
Homojen Karışımlar: Bileşenler tamamen karışmış ve gözle ayırt edilemez. (Örneğin, tuzlu su)
Heterojen Karışımlar: Bileşenler ayrı ayrı gözlemlenebilir. (Örneğin, su ve yağ karışımı)
MADDE ÖZELLİKLERİ:
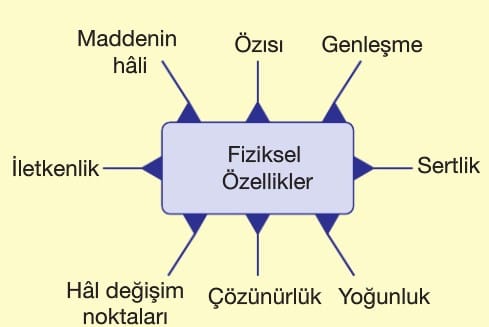
Fiziksel Özellik: Maddenin dış görünüşü ve yapısı ile ilgili, maddenin kimyasal yapısını değiştirmeyen özelliklerdir. Bu özelliklerde maddenin özü değişmez, sadece görünümü ya da hali değişebilir. Başlıca Fiziksel Özellikler: Renk, koku, tat, hal, erime ve kaynama noktası, yoğunluk, çözünürlük, sertlik/yumuşaklık, parlaklık/matlık, elektriksel iletkenlik, ısı iletkenliği, manyetiklik.
Mıknatısla ayırma, manyetik özellik taşıyan maddelerin karışımdan ayrılması için kullanılır.
Eleme yöntemi, farklı büyüklükteki katı maddeleri ayırmak için kullanılır. Kum ve çakıl gibi maddeler elek kullanılarak birbirinden ayrılır.
Kimyasal Özellik: Maddenin kimyasal yapısı ile ilgili, başka maddelerle reaksiyona girerek yeni maddeler oluşturma yeteneğini gösteren özelliklerdir.
Bu özelliklerde madde kimyasal olarak değişir, yapısı farklı bir maddeye dönüşür. Başlıca Kimyasal Özellikler: Yanıcılık, paslanma, asitlik/bazlık, zehirli olma, reaktiflik, radyoaktiflik, kararma/bozulma.
MADDELERİN AYRIŞTIRILMASI:
Fiziksel Ayırma Yöntemleri:
Maddelerin fiziksel özelliklerinden yararlanılarak yapılan ayırma işlemlerine fiziksel ayırma yöntemleri denir. Bu işlemlerde karışımı oluşturan maddelerin kimyasal yapısı değişmez, sadece fiziksel olarak birbirinden ayrılır.
Süzme yöntemi, katı–sıvı heterojen karışımların ayrılmasında kullanılır. Bu yöntemde karışımdaki sıvı, süzgeçten geçerken katı maddeler geride kalır.
Buharlaştırma yöntemi, sıvı içinde çözünmüş katıların ayrılmasında kullanılır. Sıvı buharlaşırken çözünmüş katı madde geride kalır. Tuzlu sudan tuz elde etmek bu yönteme örnektir.
Damıtma (destilasyon) yöntemi, farklı kaynama noktalarına sahip sıvıların ya da sıvı–katı çözeltilerinin ayrılmasını sağlar.
Ayırma hunisi yöntemi, birbirine karışmayan sıvıların yoğunluk farkından yararlanarak ayrılmasını sağlar.
Yüzdürme yöntemi, yoğunluk farkı ile katı maddeleri sıvı içinde ayırmaya yarar. Hafif olan maddeler yüzeye çıkar, ağır olanlar dibe çöker. Saman ve taş karışımı bu yönteme örnektir.
Santifüjleme, sıvı–katı karışımların yoğunluk farkıyla yüksek hızda döndürülerek ayrılmasıdır. Kanın bileşenlerine ayrılması santifüjleme ile yapılır.
Çöktürme yöntemi, katı–sıvı karışımlar bekletildiğinde yoğun olan katıların dibe çökmesi esasına dayanır. Çamurlu suyun bekletilerek ayrılması bu yönteme örnektir.
Kristallendirme, çözeltiden katı maddeyi kristal hâlinde geri kazanmak için kullanılır. Bu yöntemle şekerli sudan şeker kristalleri elde edilebilir.
Kimyasal ayrılma yöntemleri, bileşiklerin ya da maddelerin kimyasal tepkimelere sokularak birbirinden ayrılması işlemidir. Bu işlemler sırasında maddelerin kimyasal yapısı değişir ve yeni maddeler oluşabilir. Bu yöntemler karışımlarda değil, genellikle bileşiklerin ayrıştırılması için kullanılır.
Biyolojik ayırma yöntemi, organik maddelerin mikroorganizmalar veya enzimler yardımıyla ayrılmasını sağlar. Bu yöntem daha çok gıda ve biyoteknoloji alanlarında kullanılır.
Fotoliz, yani ışıkla ayrıştırma yönteminde ise, bileşikler güneş ışığı veya başka bir ışık kaynağı kullanılarak parçalanır. Bu yöntemde ışık enerjisi, molekülün kimyasal bağlarını kırarak onu oluşturan maddelere ayırır.
Elektroliz, elektrik akımı kullanılarak bileşiklerin kendisini oluşturan elementlere ayrılması işlemidir. Bu yöntemde, iyonik bileşikler sıvı hâlde ya da sulu çözeltideyken elektrik akımı uygulanır ve bileşik pozitif ve negatif iyonlarına ayrılır.
Termik ayrıştırma, bileşiklerin yüksek sıcaklıkta ısıtılarak daha basit maddelere ayrılması işlemidir. Bu yöntemde ısı enerjisi, bileşiği oluşturan kimyasal bağları kırarak yeni maddelerin oluşmasına neden olur.
Kimyasal çöktürme yöntemi, iki çözelti birbiriyle tepkimeye sokularak çözünmeyen bir katının (çökelek) oluşması prensibine dayanır. Oluşan bu katı madde çökelir ve böylece karışımdan ayrılır.
Nötralleşme, bir asitle bir bazın kimyasal tepkimeye girerek su ve bir tuz oluşturmasıdır. Bu yöntemle çözeltiler içerisindeki asidik ya da bazik maddeler nötral hâle getirilerek ayrılabilir.
Redoks tepkimeleri, maddeler arasında elektron alışverişi ile gerçekleşen kimyasal değişimlerdir. Bu yöntemle bileşiklerdeki elementlerin indirgenerek ya da yükseltgenerek ayrılması sağlanır.
Kimyasal ekstraksiyon, bir bileşikteki belirli maddelerin uygun bir çözücü yardımıyla kimyasal reaksiyon oluşturularak ayrılmasıdır. Bu yöntemde ayrılmak istenen madde, diğer bileşenlerden kimyasal özelliklerine göre farklı şekilde çözülerek ayrılır. Özellikle ilaç üretimi ve organik bileşiklerin saflaştırılmasında kullanılır.
MADDENİN ENERJİYLE İLİŞKİSİ:
Maddeler, katı, sıvı ve gaz gibi farklı hallerde bulunabilir. Bu hallere, enerji eklenmesi veya enerji verilmesiyle geçiş yapılır. Maddelerin hâl değişimleri sırasında, kinetik enerji (taneciklerin hareketiyle ilgili), potansiyel enerji (tanecikler arasındaki bağlarla ilgili) ve ısı gibi iki ana enerji türü önemli rol oynar.
Kinetik Enerji: Taneciklerin hareketiyle ilgilidir. Tanecikler daha hızlı hareket ettikçe, kinetik enerji artar.
Potansiyel Enerji: Tanecikler arasındaki bağların gücüyle ilgilidir. Katı hâlde bu bağlar daha güçlü olduğu için potansiyel enerji daha yüksektir. Sıvı hâle geçtiğinde bu bağlar zayıflar ve potansiyel enerji düşer. Gaz hâlinde ise bu bağlar neredeyse yoktur, dolayısıyla potansiyel enerji en düşüktür.
İç Enerji: İç enerji, bir sistemdeki toplam enerji miktarını ifade eder. Bu, hem kinetik enerji hem de potansiyel enerjinin toplamıdır. Isı eklenmesi veya çıkarılması iç enerjiyi değiştirir, bu da maddelerin fiziksel hâl değişimlerini (katıdan sıvıya, sıvıdan gaza) etkiler.
Kimyasal Enerji: Kimyasal enerji, maddelerin atomları ve molekülleri arasındaki bağlarda depolanan enerjidir. Kimyasal reaksiyonlar sırasında bu enerji serbest kalabilir ve ısı enerjisi olarak çevreye aktarılabilir. Bu enerji, özellikle yanma gibi kimyasal reaksiyonlarda açığa çıkar.