HISTOPROCESAMIENTO
OBTENCIÓN DE MUESTRA
BIOPSIAS
B.Incisional
B. Excisional
B.por punción
NECROPSIAS
IMPRONTAS
FROTIS
SEDIMENTOS
APLASTADOS CELULARES
OTRAS FUENTES:
Tejidos vegetales y animales marinos
Cultivos celulares
Fluidos corporales
Muestras inorganicas
FIJACIÓN
Según objetivo de estudio
Seleccionar:
FIJADOR
Clasificación
Pueden ser:
Físicos
Calor
Frío
Congelación
Desecación
Químicos
Simples
Mezclas
Según su acción:
F. coagulantes
F. no coagulantes
F. aditivos
F. no aditivos
F. penetrantes
F. poco penetrantes
F. que no alteran
volumen celular
F. que aumentan
volumen celular
F. que disminuyen
volumen celular
MÉTODO DE FIJACIÓN
F. in situ
F. por perfusión
F. por inmersión
F. por vapores
Considerar:
Grosor y naturaleza
de la muestra
Velocidad de fijación
Velocidad de penetración
Temperatura de fijación
Volumen de fijador
pH de la solución fijadora
Uso de vacío y/o
agitación
Puede ser:
Estudio morfológico a
microscopia de luz
Estudio morfológico a microscopia
electrónica (MET y/o MEB)
Estudio Histoquímico
Estudio Inmunocitoquímico
o Inmunohistoquímico
DESHIDRATACIÓN
Según objetivo de estudio
Eleccion del deshidratante
Etanoles
Acetonas
Se realiza por:
Inmersión de los tejidos en
líquidos deshidratantes
Finalidad:
Desplazar el agua de los tejidos
Considerar:
Rápida difusión del agua intra/extracelular
en las muestras deshidratadas.
Por lo tanto:
Se usan alcoholes en graduación ascendente
Ejemplo: uso secuencial de etanol al
70%-80%-96%-100%-100%-100%
ACLARACIÓN
Se realiza por:
Inmersión de los tejidos en
solventes orgánicos
Finalidad:
Remplazar el alcohol de los tejidos
por estos "líquidos intermediarios"
Ejemplo: Xilol
Considerar:
Tiempo de aclaración
Tiempo prolongado
provoca endurecimiento
de la muestra
Presencia de agua
Formación de precipitado
blanquecino por deshidratación
insuficiente.
IMPREGNACIÓN
Se realiza por:
Infiltración de los tejidos en
el medio de inclusión
Se utilizan varios baños de parafina
o paraplast (generalmente 3-4) a 60°
Finalidad:
Eliminar el liquido intemediario
Considerar:
Tamaño de la muestra para
tiempo de impregnación
Uso:
Manualmente en estufa
Automáticamente en
un procesador
INCLUSIÓN
Medio Hidrófobo
Formación del bloque de inclusión
por solidificación del medio de
inclusión a temperatura ambiente
Pueder ser:
Proceso automatizado
Autotec
Proceso Semimanual
Centro de inclusión
Proceso manual
Uso de:
Contenedores en estufa
Termos histologicos
Cantaros de ceramica
Se usan diferentes moldes, donde:
1. Se agrega parafina liquida
2. Mediante uso de pinzas calientes
se orienta y se pone la muestra a
incluir.
3. Se coloca sobre una platina fría
para la solidificación del bloque
Consideraciones:
Orientación de la muestra
según cara de corte y
dureza de la muestra
Temperatura de la parafina
en la zona caliente
Ejemplo: parafinas duras a 60°
Rotular correctamente
los casetes.
Mantener el orden
de las muestras
Medio Hidrófilo
Se realiza:
Posterior a la fijación y
lavado de la muestra
Impregnación en estufa
a 37°-40°.
Mediante la utilización de:
Gelatinas
OCT (soportante)
Agar
Polietilenglicol
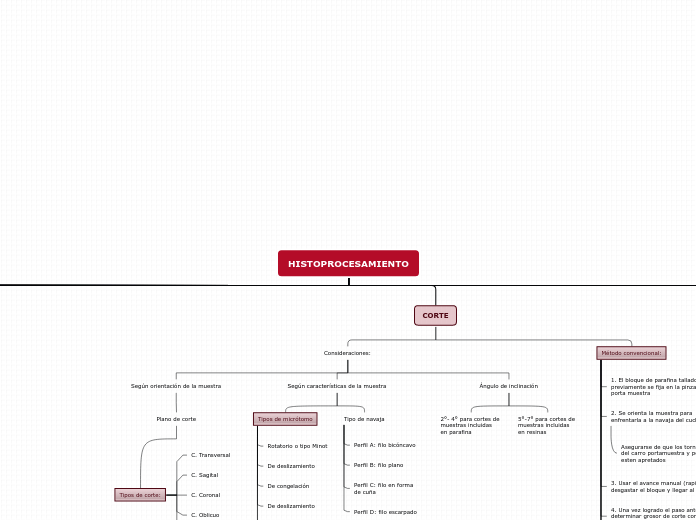
CORTE
Consideraciones:
Según orientación de la muestra
Plano de corte
Tipos de corte:
C. Transversal
C. Sagital
C. Coronal
C. Oblicuo
C. Longitudinal
Según características de la muestra
Tipos de micrótomo
Rotatorio o tipo Minot
De deslizamiento
De congelación
De deslizamiento
Criostato
Ultramicrotomo
Tipo de navaja
Perfil A: filo bicóncavo
Perfil B: filo plano
Perfil C: filo en forma
de cuña
Perfil D: filo escarpado
Ángulo de inclinación
2°- 4° para cortes de
muestras incluidas
en parafina
5°-7° para cortes de
muestras incluidas
en resinas
Método convencional:
1. El bloque de parafina tallado
previamente se fija en la pinza
porta muestra
2. Se orienta la muestra para
enfrentarla a la navaja del cuchillo
Asegurarse de que los tornillos
del carro portamuestra y portacuchillo
esten apretados
3. Usar el avance manual (rapido) para
desgastar el bloque y llegar al tejido
4. Una vez logrado el paso anterior,
determinar grosor de corte con el
cuenta micrones
5. Con la mano derecha accionar la rueda
del microtomo y con la mano izquierda
recojer la cinta
6. Depositar la cinta en el baño histológico
Agua corriente a 40° para estirar los cortes
7. Recuperar el corte con un portaobjeto limpio
8. Secado de los portaobjetos
Para eliminar el exceso de agua
Se realiza en estufa a:
60° por 1 hora
37° por 24 horas
MEDIO DE ADHESIÓN
Utilidad:
Adherir el corte al portaobjeto
de mejor forma
Puede ser:
Forma aislada
(1 corte)
Forma de cinta
( 2 o + cortes)
Tipos de medios adhesivos:
Según poder de adherencia
(menor a mayor):
1. Albumina de huevo
de Paul Mayer
2. Cola Fría al
1% acuosa
3. Gelatina
Cromalumbre
4. Silane al 2%
en acetona
Es el más utilizado
"Silanización de portaobjetos"
Favorece la adhesión de los
cortes por acción de cargas
Se debe:
1. Sumergir los portaobjetos en alcohol
acido al 1% durante 1 hora.
2. Secar los portaobjetos en estufa
o con paño batista
3. Sumergir los portaobjetos en acetona P.A
durante 1 minuto y secar.
4. Sumergir los portaobjetos en un contenedor
con silane al 2% en acetona P.A durante
3-5 minutos. Luego secar en papel.
5. Sumergir en una nueva acetona P.A por 5
segundos y secar rápidamente con aire caliente
6. Secar en estufa a 60° por al menos 2 horas
7. Evaluar la calidad de los portaobjetos
Considerar:
Identificación de los
portaobjetos
Puede ser con:
Lápiz grafito
Lápiz diamante
COLORACIÓN
Uso de colorantes:
Sustancias que se unen a
estructuras tisulares y/o celulares
cediéndoles color
Deben presentar:
Cromóforo
Clasificación:
Colorantes nitrados
Colorantes azoicos
Colorantes quinoides
Auxocromo
Clasificación:
Colorantes ácidos
Colorantes básicos
Colorantes neutros
Se identifican por:
Color Index (C.I)
Mecanismo de coloración:
Enlaces o uniones químicas
Uniones ionicas
Uniones covalentes
Interacciones
hidrofóbicas
Interacciones
Fuerzas de Van
der Waals
Uniones o
puentes de
hidrógeno
Clasificaciones de coloraciones:
Simples
Combinadas
Directas
Indirectas
Progresivas
Regresivas
Panópticas
Pancrómicas
Ortocromáticas
Metacromáticas
Ácidas
Básicas
Vitales
Consideraciones:
Según solución colorante:
Concentración
Solvente a utilizar
Fuerza iónica
pH
Temperatura
Según características
del colorante
Peso molecular
Plasticidad y rigidez
de la molecula
Disposición y carga
de grupos reactivos
Naturaleza según
grumos auxocromos
"Tinción de rutina"
Hematoxilina Eosina
1. Batería de desparafinación
e hidratación
Paso previo a la coloración
Utilidad:
Quitar la parafina de los cortes e hidratarlos
Se debe:
1. Sumergir los cortes en 2-3
baños de xilol
2. Sumergir los cortes en contenedores
de alcohol en graduación descendente
Ejemplo: 100°-100°- 96°-96°-70°
2. Batería de coloración
Es una tinción sucesiva
Por lo tanto:
1. Se sumerge el corte en hematoxilina
oxidada unida a un mordiente
2. En una solución de bórax se sumerge el
corte 3-5 veces para hacer el azulamiento
3. En una solución de etanol ácido se sumerge
el corte para hacer la diferenciación
4. Se lava el corte en agua corriente
(controlando el pH)
5. Sumergir el corte en eosina 1% acuosa
Se puede añadir unas gotas de ácido acético
6. Se lava el corte en agua destilada
3. Batería de deshidratación
y aclaramiento
Paso previo al montaje de la muestra
por medios hidrófobos
Se debe:
1. Sumergir el corte rápidamente 3 veces
en los alcoholes de menor graduación.
Ejemplo: 70°-96°-96°
2. Sumergir por 3 minutos en el
alcohol de 100°
3. Sumergir por 5 minutos en el
ultimo alcohol antes del xilol
4. Sumergir el corte en xilol para
hacer el proceso de aclaramiento
MEDIO DE MONTAJE
Utilidad:
Permitir que los preparados histológicos
se conserven en el tiempo.
Entonces:
Se coloca una gota del medio de adhesión
entre la muestra y el cubreobjetos
Por lo tanto:
El preparado queda sellado
Facilitar la manipulación
de los preparados
Considerar:
El indice de refracción del
medio de montaje
Tipos de medios
de montaje:
Medios Hidrófobos
Donde las muestras posterior a la
coloración deben deshidratarse
Ejemplos:
Resina natural
Balsamo de Canada
Resina mixta
Euparal
Resina sintética
Entellan
Medios Hidrófilos
Donde las muestras posterior a la
coloración no deben pasar por
solventes orgánicos
Ejemplos:
Gelatinas
Jarabe de Von Apathy
Gelatina de kaiser
Jarabe de Lillie y Ashburn