przez Gabriela Sgroi 5 lat temu
395
Organigrama em árvore
przez Gabriela Sgroi 5 lat temu
395

Więcej takich
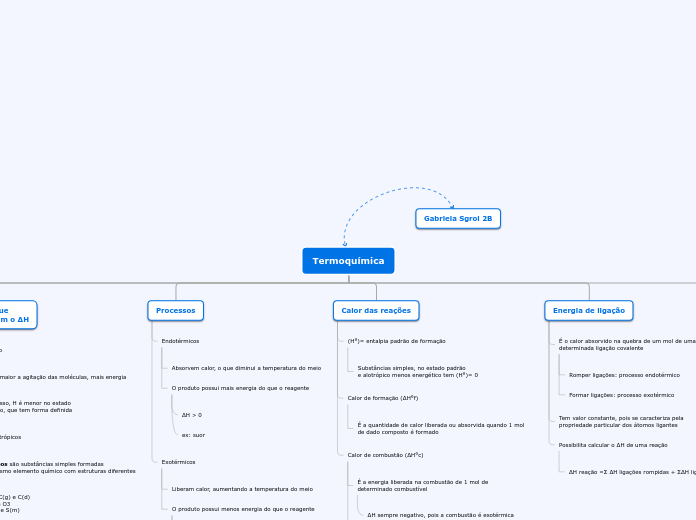
Todas as modificações feitas devem envolver o ΔH
Energia liberada na queima de uma unidade de massa de combustível (KJ/g, Kcal/g, etc.)
ΔH sempre negativo, pois a combustão é exotérmica
ex: combustão
ΔH < 0
ex: suor
ΔH > 0
Portanto, se houver um aumento dela haverá um aumento no ΔH também
Como possuem mais energia, eles interferem no ΔH
ex: C(g) e C(d) O2 e O3 S(r) e S(m)
Por isso, H é menor no estado sólido, que tem forma definida
cal: quantidade de calor necessária para elevar 1g de água em 1℃
25℃ e 1 atm Estado físico mais abundante