av Schulte Martinez Laura 3 år siden
596
PROPIEDADES FÍSICAS Y QUÍMICAS DE LA MATERIA. MODELOS EXPLICATIVOS
av Schulte Martinez Laura 3 år siden
596

Mer som dette
Ejercicio en el que se aplica la hipótesis de Avogadro
SON DIATÓMICOS TODOS LOS GASES MENOS LOS NOBLES
En mismas condiciones de temperatura y presión, volúmenes iguales tienen el mismo número de partículas
ejemplo
Los volúmenes de los reactivos y la de los productos, en las mismas condiciones de presión y temperatura, guardan una relación de números enteros.
Explicación a partir del ejemplo
Las diferentes masas de los elementos que se combinan con una masa fija del otro, guardan entre sí una relación de números enteros sencillos.
m (reactivo 1) + m (reactivo 2)= m (producto) m (1 y 2)= proporción cte
Cuando 2 o más elementos se combinan, lo hacen manteniendo una proporción de masa constante
Ejemplo
m (reactivos) = m (producto)
La materia NO se CREA NI se DESTRUYE, solo SE TRANSFORMA
T (0K )= Cesa el movimiento
-T=- mov. de partículas
+T=+ mov. de partículas
GASES: ENLACE MUY DEBIL="ROMPE" movimiento total de las partículas
LÍQUIDOS: ENLACE MÁS DEBÍL QUE EL DE LOS SÓLIDOS el movimiento de la partículas es mayor que el de los sólidos
SÓLIDOS: ENLACE FUERTE impide que las partículas se separen, por lo que habrá menor movimiento de partículas
De la fórmula:
y= k
x
k= constante de proporcionalidad.
k= x· y
Type in the subject of your essay.
Composición centesimal (%en masa de cada elemento)
Comparar masa de cada elemento con la masa total del compuesto y multiplicar · 100
Fórmulas
Molecular
Elementos+ exactamente cuántos átomos hay
Empírica
Elementos+ proporción en cómo se combinan
1 MOL de un compuesto, equivale a su MASA MOLECULAR expresada en GRAMOS.
Número de Avogadro
Avogadro:
Mismos volúmenes de distintos gases= mismo número de partículas, por lo tanto:
"1 mol de distintos gases= mismo número de partículas"
MASA MOLECULAR RELATIVA
Suma de las masas atómicas de cada uno de los elementos por cada uno de sus átomos
MASA ATÓMICA RELATIVA *adimensional*
Es la masa de sus átomos en relación a la doceava parte de la masa del átomo de carbono 12.
*se obtiene de la tabla periódica"
Unidad 1u= 1,6605· 10^-27 kg
1unidad (u)= masa que corresponde a la doceava parte del átomo del isótopo del carbono 12.
poca proporción de soluto
gran proporción de soluto
Fracción molar (X)
Molalidad (m)
Molaridad (M)
Fórmula
Ejemplo:
Examples
densidad
Fórmula+ ejemplo
%masa
%volumen
concentración en masa
menor proporción
mayor proporción
DENSIDAD DE LOS GASES IDEALES
Calcular la densidad:
Calcular la masa molar:
En el número de moles (n), interviene la masa (m) y la masa molar (M)
perspective C
EC. ESTADO D E GASES IDEALES
ECUACIÓN:
n moles de un gas cualquiera= R· n (nº de moles)
1 mol de un gas cualquiera= R (constante)= 0,082 atm L/K·mol
EC. GASES IDEALES
GASES cuya T (temperatura) > T (ebullición)
.
UNIDADES:
V= L/m³
P= atm, Pa, mmHg
Presión y Volumen: se puede elegir en que unidades, siempre que sean las mismas
T= K (siempre)
In the main body of your essay, you should list your arguments which will support your thesis.
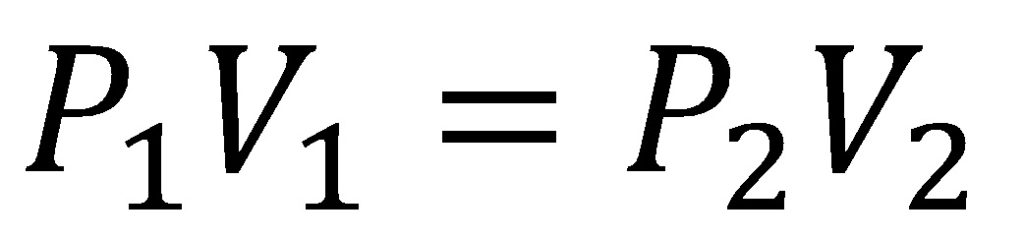
T= cte
Estudia la relación entre V (volumen) y P (presión).
You can choose to argue from different perspectives. For example, you can choose to agree or disagree or remain objective of the main idea.
CONCLUSIÓN-LEY
T

MÉTODO CIENTÍFICO
P= cte
Estudia la relación entre V (volumen) y T (temperatura).
You can choose to argue from different perspectives. For example, you can choose to agree or disagree or remain objective to the main idea.
CONCLUSIÓN-LEY
T

MÉTODO CIENTÍFICO
---
EJEMPLO:
Theory
V= cte
Estudia la relación entre P (presión) y T (temperatura).